Artykuł z MDPI https://www.mdpi.com/1660-4601/17/14/5131/htm#
Nie odpowiadamy za tłumaczenie ale zachęcamy do lektury.
Działanie bakteriobójcze gotowych do użycia chusteczek komercyjnych na bazie alkoholu zgodnie z normą EN 16615 Carrier
autor: Patryk Tarka 1,* ORCID,Agnieszka Chojecka 2,Olga Paduch 2,Aneta Nitsch-Osuch 1,Krzysztof Kanecki 1ORCID iAnna Kierzkowska 2
1Katedra Medycyny Społecznej i Zdrowia Publicznego Warszawskiego Uniwersytetu Medycznego, ul. Oczki 3, 02-007 Warszawa, Polska
2Pracownia Zwalczania Czynników Zakaźnych i Zanieczyszczeń Biologicznych, Zakład Bakteriologii i Kontroli Biozanieczy, Państwowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, ul. Chocimska 24, 00-791 Warszawa, Polska
*
Autor, do którego należy kierować korespondencję.
Int. J. Environ. Res. Zdrowie publiczne 2019, 16(18), 3475; https://doi.org/10.3390/ijerph16183475
Otrzymano: 29 lipca 2019 / Zmieniono: 7 września 2019 / Zaakceptowano: 16 września 2019 / Opublikowano: 18 września 2019
(Ten artykuł należy do sekcji Zachowania zdrowotne, Choroby przewlekłe i promocja zdrowia)
Abstrakt
Wstęp: Skuteczność gotowych do użycia chusteczek dezynfekujących była wcześniej oceniana w standaryzowanych testach zawiesiny, które były niewystarczające, ponieważ ignorowały fakt, że chusteczki są pocierane o powierzchnię. W ten sposób oceniliśmy skuteczność dostępnych na rynku chusteczek dezynfekujących impregnowanych roztworem alkoholowym zgodnie z normą 16615, która obejmuje test o działaniu mechanicznym. Metody: Zgodnie z normą EN 16615, w czystych warunkach, na powierzchni testowej zaznaczono cztery kwadraty (5 cm × 5 cm), umieszczone obok siebie. Enterococcus hirae, Pseudomonas aeruginosa i Staphylococcus aureus zostały zaszczepione na skrajnym lewym kwadracie, a chusteczka zaimpregnowana roztworem alkoholowym została umieszczona na lewo od tego kwadratu. Następnie chusteczka została dociśnięta z ciężarem 2,5 kg i przesunięta w prawo i z powrotem w lewo. Po czasie kontaktu wynoszącym 1, 5, 10 lub 15 minut zmierzyliśmy zmniejszenie obciążenia bakteryjnego. Wyniki: Gotowe do użycia chusteczki komercyjne na bazie alkoholu nie wykazywały wystarczającej aktywności bakteriobójczej w czasie kontaktu 1, 5, 10 i 15 min. Chusteczki zawierające propan-1-ol i mieszaninę propan-1-ol i propan-2-ol były aktywne przeciwko Pseudomonas aeruginosa w czasie kontaktu 1 min i 15 min. Żadna z badanych chusteczek nie była aktywna przeciwko Enterococcus hirae lub Staphylococcus aureus. Wniosek: Parametry bakteriobójcze gotowych chusteczek dezynfekujących powinny być określane w badaniach powierzchniowych, oprócz testów zawiesinowych, ponieważ testy zawiesinowe nie symulują warunków, w jakich chusteczki dezynfekujące są stosowane w praktyce.
Słowa kluczowe: dezynfekcja; EN 16615; gotowe do użycia chusteczki na bazie alkoholu; czas kontaktu; działanie bakteriobójcze
- Wprowadzenie
Skuteczność produktów do dezynfekcji wymagających działania mechanicznego nie została odpowiednio zbadana [1,2,3]. Na przykład testy zawiesiny zostały wykorzystane do oceny skuteczności roztworów, w których impregnowane są chusteczki dezynfekujące, ale ignorują, że chusteczki muszą być pocierane o powierzchnię [4,5]. Ponadto tkanina chusteczek dezynfekujących może zmniejszać aktywność środka dezynfekującego. Chociaż istnieją testy skuteczności produktów do dezynfekcji powierzchni (faza 2, etap 2 test EN13697, prEN 17387), stosują one duże ilości środków dezynfekujących (318 ml / m2) i nie obejmują mechanicznego działania wycierania.
Natomiast norma europejska EN 16615 zawiera znormalizowany test 4-polowy, który symuluje mechaniczne działanie wycierania powierzchni [6]. Test mierzy zmniejszenie zanieczyszczenia bakteriami i drożdżami, które są inokulowane na płaskiej powierzchni polichlorku winylu (PVC) [7]. Norma EN 16615 jest przydatna szczególnie w przypadku produktów do dezynfekcji stosowanych w placówkach medycznych [8]. Ponadto w normie EN 16615 można ocenić, czy dana chusteczka dezynfekująca rozprzestrzenia zanieczyszczenia mikrobiologiczne na badanej powierzchni [7,9,10].
W placówkach medycznych chusteczki dezynfekcyjne są zazwyczaj stosowane w celu zmniejszenia zanieczyszczenia mikrobiologicznego na często używanych powierzchniach [3,11,12,13]. Dlatego środki dezynfekujące, w których impregnowane są chusteczki, powinny mieć krótki czas kontaktu i szerokie spektrum działania przeciwdrobnoustrojowego [2]. W praktyce dostępne na rynku chusteczki dezynfekcyjne są zazwyczaj impregnowane w roztworach na bazie alkoholu i są używane do dezynfekcji małych powierzchni [14,15].
W badaniu tym oceniono działanie bakteriobójcze, zgodnie z normą EN 16615, kilku gotowych do użycia, dostępnych na rynku chusteczek dezynfekujących impregnowanych roztworami alkoholowymi.
- Materiały i metody
2.1. Chusteczki dezynfekcyjne
Zastosowaliśmy cztery rodzaje dostępnych na rynku chusteczek dezynfekujących (chusteczki A–D), o czasach kontaktu od 30 s do 60 s (na podstawie testów zawiesiny, EN 13727; Tabela 1).
Tabela 1. Receptury gotowych do użycia chusteczek dostępnych na rynku według producentów.

2.2. Badanie 4-polowe
Zgodnie z normą EN 16615 do pomiaru skuteczności chusteczek dezynfekujących wykorzystaliśmy test 4-polowy (ryc. 1). Krótko mówiąc, cztery kwadratowe pola, 5 cm × 5 cm każde, zostały oznaczone na płaskiej płycie PVC (20 × 50 cm2) warstwowej poliuretanu (patrz rysunek 1; DLW Solid Pur 521-029; Armstrong). Pole 1 zaszczepiono 50 μl roztworów zawierających Staphylococcus aureus (ATCC 6538), Pseudomonas aeruginosa (ATCC 15442) i Enterococcus hirae (ATCC 10541) w stężeniach 1,5 × 109 do 5,0 × 109 jednostek tworzących kolonie (jTK)/ml (roztwór albuminy bydlęcej, 0,3 g/l, warunki czyste). Roztwory pozostawiono do wyschnięcia w szafce bezpieczeństwa biologicznego przez około 1 h. Następnie na lewo od pola 1 umieszczono chusteczkę dezynfekującą i dociskano ją ciężarem (blok granitowy 12,1 cm × 8,6 cm × 8,6 cm, około 2,5 kg). Ciężar został przeniesiony w prawo przez wszystkie pola z ciągłym ruchem, który trwał 1 s, a następnie został przeniesiony z powrotem, ponad 1 s, do pierwotnej pozycji. Chusteczki ważono przed i po wytarciu. Różnica w wadze została przyjęta jako miara uwalniania roztworu dezynfekującego z chusteczek.
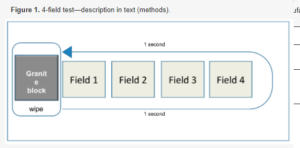
Ryc. 1. Test 4-polowy — opis w tekście (metody).
Natychmiast po wytarciu (N0) i pod koniec czasu kontaktu (1, 5, 10, 15 min) bakterie zostały odzyskane z każdego pola testowego za pomocą wacików z bawełny. Dla każdego pola testowego (1-4) użyliśmy dwóch pałeczek do wacików i jednej rurki z neutralizatorem (30 g / L Polisorbat 80; 3 g / L lecytyna; 1 g / L L-histydyna; 30 g / L saponina w rozcieńczalniku chlorku sodu tryptony). Najpierw pole testowe zostało przetarte jednym wacikiem nasączonym neutralizatorem, a wacik został przemyty w neutralizatorze, aby zapobiec działaniu środka dezynfekującego. Procedurę tę powtórzono raz, a końcówkę pałeczki wacika odcięto i pozostawiono w tubie neutralizatora. Następnie pole testowe przetarto suchym wacikiem, który również umieszczono w tubie neutralizatora, a rurkę wstrząsnięto. Po okresie neutralizacji (15 s dla czasu kontaktu <15 min; 5 min dla czasu kontaktu ≥15 min) 1 ml próbek zneutralizowanych zawiesin testowych inkubowano na płytkach agarowych w poczwórnym w temperaturze 37 °C przez 48 h. Obciążenie bakteryjne zostało policzone i wyrażone w lg CFU/ml.
2.3. Urządzenia sterujące do badania 4-polowego
W teście 4-polowym zastosowaliśmy następujące kontrole: (1) Początkowe obciążenie bakteryjne (N) – gęstość bakterii inkubowanych z zawiesiny testowej; (2) kontrola suszenia (Dc0) – gęstość bakterii odzyskanych z wysuszonego zaszczepienia z oddzielnej płytki (w celu oceny utraty bakterii podczas suszenia); (3) kontrola czasu kontaktu (Dct) – gęstość bakterii odzyskanych z oddzielnej płytki po określonym czasie kontaktu (odniesienie do obliczania redukcji obciążenia bakteryjnego); (4) kontrola wody – bakterie odzyskane z pól 1–4, które wytarto standardowymi chusteczkami (SCA Tork) nasączonymi przez 30 min w 16 ml sterylnej wody destylowanej z dodatkiem 0,1% polisorbatu 80; (5) Kontrola neutralizatora – w procedurze kontroli neutralizatora nie potwierdzono toksyczności neutralizatora przeciwko badanym bakteriom.
Zgodnie z normą EN 16615 skuteczne działanie bakteriobójcze zdefiniowano jako redukcję ≥5 lg dla E. hirae, P. aeruginosa i S. aureus na polu testowym 1 oraz obciążenie bakteryjne ≤50 jtk na 25 cm2 na polach testowych od 2 do 4 dla każdego badanego organizmu. Rozprzestrzenianie się bakterii podczas wycierania potwierdzono, gdy obciążenie bakteryjne wynosiło >50 jtk na 25 cm2 na polach testowych od 2 do 4.
2.4. Analizy statystyczne
Dane zostały przeanalizowane za pomocą programu Microsoft Excel 2007. Przedstawiono średnie wartości ± odchylenia standardowe.
- Wyniki
3.1. Uwalnianie roztworu środka dezynfekującego z chusteczek
Kontrolne chusteczki wodne uwolniły 1,33 ± 0,2 g wody. Ilość środka dezynfekującego uwolnionego z chusteczek A wynosiła 1,26 ± 0,6 g, z chusteczek B wynosiła 0,75 ± 0,1 g, z chusteczek C wynosiła 0,87 ± 0,2 g, a z chusteczek D wynosiła 0,62 ± 0,1 g.
3.2. Odzyskiwanie bakterii z pól badawczych
Odzyskiwanie bakterii z zawiesiny testowej (N) i z powierzchni badanej natychmiast po wytarciu (N0) było zgodne z normą EN 16615 (rysunek 2, rysunek 3 i rysunek 4).
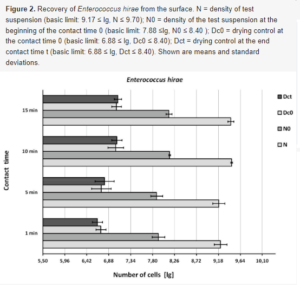
Ryc. 2. Odzyskiwanie Enterococcus hirae z powierzchni. N = gęstość zawiesiny badawczej (podstawowa wartość graniczna: 9,17 ≤ lg, N ≤ 9,70); N0 = gęstość zawiesiny badawczej na początku czasu kontaktu 0 (podstawowa wartość graniczna: 7,88 ≤lg, N0 ≤ 8,40 ); Dc0 = kontrola suszenia w czasie kontaktu 0 (granica podstawowa: 6,88 ≤ lg, Dc0 ≤ 8,40); Dct = kontrola suszenia na końcu czasu kontaktu t (podstawowa granica: 6,88 ≤ lg, Dct ≤ 8,40). Pokazano średnie i odchylenia standardowe.
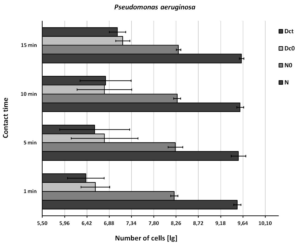
Ryc. 3. Odzyskiwanie Pseudomonas aeruginosa z powierzchni. N = gęstość zawiesiny badawczej (podstawowa wartość graniczna: 9,17 ≤ lg, N ≤ 9,70); N0 = gęstość zawiesiny badawczej na początku czasu kontaktu 0 (podstawowa wartość graniczna: 7,88 ≤lg, N0 ≤ 8,40 ); Dc0 = kontrola suszenia w czasie kontaktu 0 (granica podstawowa: 6,88 ≤ lg, Dc0 ≤ 8,40); Dct = kontrola suszenia na końcu czasu kontaktu t (podstawowa wartość graniczna: 6,88 ≤ lg Dct ≤ 8,40). Pokazano średnie i odchylenia standardowe.
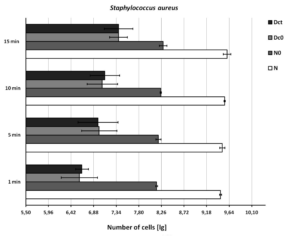
Ryc. 4. Odzyskiwanie Staphylococcus aureus z powierzchni. N = gęstość zawiesiny badawczej (podstawowa wartość graniczna: 9,17 ≤ lg, N ≤ 9,70); N0 = gęstość zawiesiny badawczej na początku czasu kontaktu 0 (podstawowa wartość graniczna: 7,88 ≤ lg, N0 ≤ 8,40 ); Dc0 = kontrola suszenia w czasie kontaktu 0 (granica podstawowa: 6,88 ≤ lg, Dc0 ≤ 8,40); Dct = kontrola suszenia na końcu czasu kontaktu t (podstawowa granica: 6,88 ≤ lg, Dct ≤ 8,40). Pokazano średnie i odchylenia standardowe.
Odzyskiwanie bakterii z kontroli suszenia (Dc0) i kontroli czasu kontaktu (Dct) było podobne, ale poniżej normy EN 16615 (6,88 ≤ lg ≤ 8,40, rysunek 2, rysunek 3 i rysunek 4), gdy testowana zawiesina bakteryjna znajdowała się w dolnym zakresie. Odzyskiwanie bakterii z kontroli suszenia (Dc0) i kontroli czasu kontaktu (Dct) poprawiło się do dopuszczalnych wartości, gdy stężenie zawiesiny testowej zostało zwiększone (E. hirae, 9,46 lg; P. aeruginosa, 9,61 lg; S. aureus, 9,50 lg).
3.3. Zmniejszenie obciążenia bakteryjnego po wytarciu
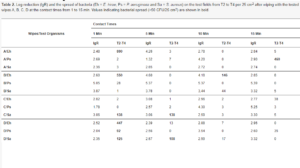
Zmniejszenie obciążenia bakteryjnego na polu 1 po wytarciu nie spełniło kryterium normy EN 16615. Żadna z chusteczek (A–D) nie zmniejszyła obciążenia bakteryjnego o >5 lg dla wszystkich szczepów bakterii (Tabela 2). Zmniejszenie obciążenia bakteryjnego >5 lg obserwowano dla chusteczek B tylko w teście z P. aeruginosa (Tabela 2). Średnia aktywność bakteriobójcza badanych chusteczek wahała się od 2,76 lg ± 0,73 przy 1 min kontaktu do 3,50 lg ± 0,56 przy 10 min kontaktu. Średnia aktywność bakteriobójcza przeciwko bakteriom Gram-dodatnim wynosiła 2,47 lg ± 0,14 do 3,69 lg ± 1,17, podczas gdy przeciwko bakteriom Gram-ujemnym wynosiła 2,89 lg ± 1,49 do 4,35 lg ± 0,76.
Tabela 2. Redukcja logarytmiczna (lgR) i rozprzestrzenianie się bakterii (Eh = E. hirae, Ps = P. aeruginosa i Sa = S. aureus) na polach badawczych od T2 do T4 na 25 cm2 po wytarciu badanymi chusteczkami A, B, C, D w czasie kontaktu od 1 do 15 min. Wartości wskazujące na rozprzestrzenianie się bakterii (>50 jtk/25 cm2) są pogrubione.
3.4. Rozprzestrzenianie się bakterii po wytarciu
Niektóre chusteczki rozprzestrzeniają bakterie z pola 1 na pola 2-4 (> 50 jtk / 25 cm2, Tabela 2), chociaż rozprzestrzenianie się bakterii było zmniejszone w porównaniu z kontrolą wody (Tabela 3). Nie stwierdzono wzorca między czasem kontaktu a rozprzestrzenianiem się bakterii (Tabela 2).
Tabela 3. Średnia liczba odzyskanych bakterii (Eh = E. hirae, Ps = P. aeruginosa; Sa = S. aureus) na polach badawczych od T2 do T4 po przetarciu wodą (Nw).

- Dyskusja
W tym badaniu skuteczność chusteczek dezynfekujących impregnowanych roztworami na bazie alkoholu nie spełniła kryterium normy EN 16615, która wymaga testu z działaniem mechanicznym. Co więcej, wycieranie rozprzestrzenia bakterii w niektórych eksperymentach.
Norma EN 16615, w przeciwieństwie do norm zawieszenia, symuluje wiele praktycznych aspektów dezynfekcji z wycieraniem w placówkach medycznych, w tym rodzaj powierzchni, mikroorganizmy testowe przylegające do powierzchni oraz mechaniczne działanie wycierania [2,7]. Ponadto ocenia się również odzyskiwanie mikroorganizmów z powierzchni i rozprzestrzenianie się drobnoustrojów podczas wycierania [7]. W związku z tym norma EN 16615 jest bardziej wymagająca niż normy zawieszenia.
W placówkach medycznych chusteczki dezynfekujące są zazwyczaj stosowane do szybkiej dezynfekcji małych i często używanych powierzchni. Chusteczki dezynfekcyjne są często impregnowane alkoholem, ponieważ alkohol zabija bakterie, drożdże, grzyby i wirusy po krótkim czasie kontaktu. W wyniku ich niskiej masy cząsteczkowej alkohol łatwo odparowuje z powierzchni bez efektu resztkowego [16,17]. Jednak lotność alkoholu może skrócić czas kontaktu, a tym samym zmniejszyć ich aktywność przeciwdrobnoustrojową [17].
W teście 4-polowym środek dezynfekujący uwolniony z chusteczki jest rozprowadzany jako cienka warstwa, która szybko odparowuje z powierzchni w temperaturze pokojowej. Krótki czas kontaktu środka dezynfekującego z mikroorganizmami może pogorszyć skuteczność chusteczek [18]. W naszym badaniu ilość środka dezynfekującego uwalnianego z poszczególnych rodzajów chusteczek różniła się, ale różnica ta nie miała żadnego wpływu na działanie bakteriobójcze. Gebel i in. wykazali, że małe ilości środka dezynfekującego mogą nie pokrywać danej powierzchni, a tym samym mieć niewystarczającą aktywność przeciwdrobnoustrojową [18]. Nasze badania potwierdzają ten pogląd, ponieważ stwierdziliśmy, że wydłużenie czasu kontaktu, poza te przedstawione w normie EN 16165 (<5 min), nie zwiększyło aktywności bakteriobójczej chusteczek impregnowanych alkoholem, prawdopodobnie dlatego, że małe ilości alkoholu szybko odparowują
W naszym badaniu zawartość alkoholu w chusteczkach dezynfekujących wynosiła 50%–90% [16,17]. Pomimo tych różnic wszystkie chusteczki miały podobną aktywność bakteriobójczą, która nie spełniała kryterium EN 16615. Chusteczki C, zawierające propan-1-ol i propan-2-ol, miały najwyższą aktywność bakteriobójczą (przeciwko P. aeruginosa), co jest zgodne z wcześniejszymi doniesieniami [19,20]. Podobnie jak w poprzednich badaniach, odkryliśmy, że bakterie Gram-ujemne były bardziej podatne na alkohol niż bakterie Gram-dodatnie [17,19]. Andersen i in. wykazali, że redukcja bakterii za pomocą chusteczek z etanolem nie spełniała kryterium EN 16615 (< 3 lg) [21]. Nasze wyniki są zgodne z tym sprawozdaniem.
Chusteczki dezynfekujące powinny zapobiegać rozprzestrzenianiu się bakterii na powierzchniach [10]. W porównaniu z kontrolą wody, chusteczki badane w naszym badaniu zmniejszyły rozprzestrzenianie się bakterii. Jednak w niektórych eksperymentach zaobserwowaliśmy rozprzestrzenianie się bakterii, zgodnie z definicją zawartą w normie EN 16615 (Tabela 2). Inne badania wykazały, że rozprzestrzenianie się mikroorganizmów może zależeć od rodzaju chusteczki, substancji impregnującej (środek dezynfekujący lub detergent), techniki wycierania i rodzaju mikroorganizmu [2,13,22]. Działanie bakteriobójcze chusteczek dezynfekujących można poprawić, wybierając najbardziej skuteczny alkohol lub dodając substancje zmniejszające napięcie powierzchniowe, aby zapewnić lepsze nawodnienie powierzchni lub emolienty, aby zapobiec szybkiemu odparowaniu alkoholu [23]. Ponadto większe objętości środków dezynfekujących do impregnacji chusteczek mogą zwiększać ich działanie bakteriobójcze [18].
Nasze badanie miało ograniczenia. Norma EN 16615 wymaga 4-polowego testu z drożdżami. Jednak nieskuteczne działanie przeciwko bakteriom powoduje, że dany typ chusteczki nie spełnia normy EN 16615. Dlatego nie przeprowadzaliśmy eksperymentów z drożdżami. Nie porównaliśmy normy EN 16615 z innymi normami, które mogą obowiązywać w przypadku chusteczek dezynfekujących, takimi jak norma ASTM E2967-15.
- Wnioski
Dostępne w handlu chusteczki dezynfekujące impregnowane alkoholem mogą nie spełniać normy EN 16615. Podawane przez producentów czasy kontaktu mogą być zbyt krótkie, aby umożliwić skuteczne działanie bakteriobójcze chusteczek. Czasy kontaktu są oceniane w testach z większymi objętościami środków dezynfekujących, a zatem bez działania mechanicznego (EN13727) nie są ważne dla chusteczek dezynfekujących.
Przyszłe badania powinny porównywać normę EN 16165 z amerykańskimi normami ASTM E2967-15 dla chusteczek dezynfekujących.
Wkład autora
Konceptualizacja, P.T. i A.C.; metodologia, P.T., A.C. i OP;; walidacja, A.C. i OP; analiza formalna, A.C., O.P. i A.K.; dochodzenie, A.C., O.P. i A.K.; zasoby, P.T., A.N-O. i K.K.; kuracja danych, A.C.; pisanie – przygotowanie oryginalnego szkicu, A.C. i OP; pisanie – recenzja i redakcja, A.C. i P.T.; wizualizacja, A.C.; nadzór, A.N-O. i K.K.; administracja projektów, P.T. i A.C.; pozyskiwanie finansowania, P.T.
Finansowania
Badania te nie otrzymały finansowania zewnętrznego.
Podziękowania
Prace te były wspierane przez Warszawski Uniwersytet Medyczny oraz Państwowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny. Badania te nie otrzymały żadnych konkretnych dotacji od agencji finansujących w publicznych sektorach komercyjnych lub non-profit.
Konflikty interesów
Autorzy deklarują brak konfliktu interesów. Fundatorzy nie odegrali żadnej roli w projektowaniu badania; w gromadzeniu, analizach lub interpretacji danych; w piśmie manuskryptu lub w decyzji o opublikowaniu wyników.
References
Bloomfield, S.F.; Arthur, M.; Begun, K.; Patel, H. Comparative testing of disinfectants using proposed European surface test method. Lett. Appl. Microbiol. 1993, 17, 119–125. [Google Scholar] [CrossRef]
Sattar, S.A.; Maillard, J.Y. The crucial role of wiping in decontamination of high-touch environmental surfaces: Review of current status and directions for the future. Am. J. Infect. Control 2013, 41, 97–104. [Google Scholar] [CrossRef] [PubMed]
Sattar, S.A.; Bradley, C.; Kibbee, R.; Wesgate, R.; Wilkinson, M.A.C.; Sharpe, T.; Maillard, J.Y. Disinfectant wipes are appropriate to control microbial bioburden from surfaces: Use of a new ASTM standard test protocol to demonstrate efficacy. J. Hosp. Infect. 2015, 91, 319–325. [Google Scholar] [CrossRef] [PubMed]
EN 13727+A2:2015. Chemical Disinfectants and Antiseptics. Quantitative Suspension Test for the Evaluation of Bactericidal Activity of Chemical Disinfectants for Instruments Used in the Medical Area. Test Method and Requirements (Phase 2/Step 1); Polish Standards Institution: Warsaw, Poland, 2015; Available online: sklep.pkn.pl/pn-en-13727-a2-2015-12e.
Royal College of Nursing. The Selection and Use of Disinfectant Wipes. 2011. Available online: http://dhss.alaska.gov/dph/Epi/id/SiteAssets/Pages/Infection-Prevention-Boot-Camp/How%20to%20choose%20a%20disinfectant%20wipe.pdf (accessed on 25 January 2019).
Gemein, S.; Gebel, J.; Steinhauer, K.; Christiansen, B.; Martiny, H.; Meyer, B.; Ostermeyer, C.; Rödger, H.J.; Vossebein, L.; Paßvogel, L.; et al. Interlaboratory reproducibility of test method following four-field test methodology to evaluate the susceptibility of Clostridium difficile spores. J. Hosp. Infect. 2019, in press. [Google Scholar] [CrossRef] [PubMed]
EN 16615:2015. Chemical Disinfectants and Antiseptics. Quantitative Test Method for the Evaluation of Bactericidal and Yeasticidal Activity on Non-Porous Surfaces with Mechanical Action Employing Wipes in the Medical Area (4-Field Test)—Test Method and Requirements (Phase 2/Step 2); Polish Standards Institution: Warsaw, Poland, 2015. Available online: sklep.pkn.pl/pn-en-16615-2015-06e.
EN 14885:2015. Chemical Disinfectants and Antiseptics. Application of European Standards for Chemical Disinfectants and Antiseptics; Polish Standards Institution: Warsaw, Poland, 2018; Available online: sklep.pkn.pl/pn-en-14885-2019-01e.html.
Weber, D.J.; Rutala, W.A.; Miller, M.B.; Huslage, K.; Sickbert-Bennett, E. Role of hospital surfaces in the transmission of emerging health care-associated pathogens: Norovirus, Clostridium difficile, and Acinetobacter species. Am. J. Infect. Control 2010, 38, 25–33. [Google Scholar] [CrossRef] [PubMed]
Lopez, G.U.; Kitajima, M.; Havas, A.; Gerba, C.P.; Reynolds, K.A. Evaluation of a disinfectant wipe intervention of fomite-to-finger microbial transfer. Appl. Environ. Microbiol. 2014, 80, 3113–3118. [Google Scholar] [CrossRef] [PubMed]
Williams, G.J.; Denyer, S.P.; Hosein, I.K.; Hill, A.W.; Maillard, J.Y. The development of a new three-step protocol to determine the efficacy of disinfection wipes on surfaces contaminated with Staphylococcus aureus. J. Hosp. Infect. 2007, 67, 329–335. [Google Scholar] [CrossRef] [PubMed]
Otter, J.A.; Yezli, S.; French, G.L. The role played by contaminated surfaces in the transmission of nosocomial pathogens. Infect. Control Hosp. Epidemiol. 2011, 32, 687–699. [Google Scholar] [CrossRef] [PubMed]
Wesgate, R.; Robertson, A.; Barrell, M.; Teska, P.; Maillard, J.Y. Impact of test protocols and material binding on the efficacy of antimicrobial wipes. J. Hosp. Infect. 2019, 103, e25–e32. [Google Scholar] [CrossRef] [PubMed]
Panousi, M.N.; Williams, G.J.; Girdlestone, S.; Hiom, S.J.; Mailard, J.Y. Evaluation of alcohol wipes used during aseptic manufacturing. Lett. Appl. Microbiol. 2009, 48, 648–651. [Google Scholar] [CrossRef] [PubMed]
Gebel, J.; Exner, M.; French, G.; Chartier, Y.; Christiansen, B.; Gemein, S.; Goroncy-Bermes, P.; Hartemann, P.; Heudorf, U.; Kramer, A.; et al. The role of surface disinfection in infection prevention. GMS Hyg. Infect. Control 2013, 8. [Google Scholar] [CrossRef]
McDonnell, G.; Denver, R. Antiseptics and Disinfectants: Activity, action and resistance. Clin. Microbiol. Rev. 1999, 12, 147–179. [Google Scholar] [CrossRef] [PubMed]
Block, S.S. Disinfection, Sterilization, and Preservation, 5th ed.; Alcohols; Lippincott Williams & Wilkins: Philadelphia, PA, USA, 2001; Volume 12, pp. 229–253. [Google Scholar]
Gebel, J.; Gemein, S.; Kampf, G.; Pidot, S.J.; Buetti, N.; Exner, M. Isopropanol at 60% and at 70% are effective against isopropanol-tolerant Enterococcus faecium. J. Hosp. Infect. 2019, in press. [Google Scholar] [CrossRef] [PubMed]
Yamashita, M.; Takeno, A. Relationship between bactericidal activity and the hydrophobicity-hydrophilicity balance of alcohol solution. Biocontrol Sci. 2001, 6, 107–111. [Google Scholar] [CrossRef]
Kampf, G.; Kramer, A. Epidemiologic background of hand hygiene and evaluation of the most important agents for scrubs and rubs. Clin. Microbiol. Rev. 2004, 17, 863–893. [Google Scholar] [CrossRef] [PubMed]
Andersen, J.H.; Jensen, C.S.; Kristensen, B. The Structure and Absorption Capacity of Non-Woven Fabrics Influences the Disinfection Efficiency of Commercially Manufactured Disinfection Wipes. In The Danish Microbiological Society Annual Congress 2016; American Society of Microbiology, FEMS: Copenhagen, Denmark, 2016; Available online: http://orbit.dtu.dk/files/127256055/FINAL_DMS_final_programme_abstract_book.pdf8KS_v_T.pdf (accessed on 25 November 2019).
Ramm, L.; Siani, H.; Wesgate, R.; Maillard, J.Y. Pathogen transfer and high variability in pathogen removal by detergent wipes. Am. J. Infect. Control 2015, 43, 724–728. [Google Scholar] [CrossRef] [PubMed]
Block, S.S. Disinfection, Sterilization, and Preservation, 5th ed.; Synergism in Disinfectant Formulation; Lippincott Williams & Wilkins: Philadelphia, PA, USA, 2001; Volume 22, pp. 459–473. [Google Scholar]
© 2019 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/).



















