Artykuł z MDPI https://www.mdpi.com/1660-4601/17/14/5131/htm#
Nie odpowiadamy za tłumaczenie ale zachęcamy do lektury.
Bezdotykowy zautomatyzowany system dezynfekcji do odkażania powierzchni w szpitalach
autor: Patryk Tarka *ORCID iAneta Nitsch-OsuchORCID
Katedra Medycyny Społecznej i Zdrowia Publicznego, Warszawski Uniwersytet Medyczny, ul. Oczki 3, 02-007 Warszawa, Polska
*
Autor, do którego należy kierować korespondencję.
Int. J. Environ. Res. Zdrowie publiczne 2020, 17(14), 5131; https://doi.org/10.3390/ijerph17145131
Otrzymano: 18 maja 2020 / Zmieniono: 13 lipca 2020 / Zaakceptowano: 14 lipca 2020 / Opublikowano: 16 lipca 2020
(Ten artykuł należy do Special Issue Hospital Outdoor and Indoor Environmental Impact: Control Measures)
Abstrakt
Wstęp:
Zakażenia szpitalne pozostają częstym problemem, co sugeruje, że standardowe procedury odkażania są niewystarczające. Dlatego w szpitalach potrzebne są nowe metody odkażania. Metody: Oceniliśmy skuteczność bezdotykowego systemu automatycznej dezynfekcji (NTD) w odkażaniu 50 powierzchni w 10 salach szpitalnych. Zanieczyszczenie powierzchni oceniano za pomocą testu mikrobiologicznego i testu bioluminescencji ATP. Niedopuszczalne zanieczyszczenie zdefiniowano jako > 100 jednostek tworzących kolonie/100 cm2 w teście mikrobiologicznym oraz jako ≥ 250 względnych jednostek światła w teście ATP. Wyniki: Po zmierzeniu za pomocą testu mikrobiologicznego 11 z 50 powierzchni miało niedopuszczalne zanieczyszczenie przed NTD, a żadna z powierzchni nie miała niedopuszczalnego zanieczyszczenia po NTD (p < 0,001). W teście bioluminescencji ATP NTD zmniejszyło liczbę powierzchni z niedopuszczalnym zanieczyszczeniem z 28 do 13, ale efekt ten był nieistotny (p = 0,176). W teście mikrobiologicznym wykonanym przed NTD największe zanieczyszczenie przekroczyło dopuszczalny poziom ponad 11-krotnie (oprawka lampy, 1150 jtk/100 cm2). W teście bioluminescencji ATP wykonanym przed NTD największe zanieczyszczenie przekroczyło dopuszczalny poziom ponad 43-krotnie (worek Ambu, 10 874 RLU). Wniosek: NTD skutecznie zmniejszyło zanieczyszczenie mikrobiologiczne we wszystkich salach szpitalnych. Jednak po zmierzeniu za pomocą testu bioluminescencji ATP zmniejszenie zanieczyszczenia nie było znaczące.
Słowa kluczowe: bezdotykowa automatyczna dezynfekcja; zakażenia szpitalne; perokson; Test bioluminescencji ATP; test mikrobiologiczny
- Wprowadzenie
Zakażenia szpitalne (HAI) stanowią poważny problem zdrowotny, a każdego roku diagnozuje się około 2 mln przypadków zarówno w USA, jak i w Unii Europejskiej [1,2,3]. W samych Stanach Zjednoczonych około 28-45 miliardów dolarów wydaje się każdego roku na leczenie pacjentów z zakażeniami zdrowia [4].
Patogeny wywołujące zakażenia związane z opieką zdrowotną mogą przetrwać tygodnie lub miesiące na niezdezynfekowanych powierzchniach, takich jak poręcze łóżek, sprzęt medyczny, telefony, klawiatury i kartoteki pacjentów [5,6,7,8,9]. Patogeny te są często wielolekooporne, w tym S. aureus oporny na metycylinę, odporny na karbapenem P. aeruginosa, odporny na wankomycynę E. faecium i K. pneumoniae o rozszerzonym spektrum działania odporny na β-laktamazę [10,11]. Wydaje się, że stosowanie standardowych środków czyszczących i przestrzeganie praktyk zapobiegawczych, takich jak właściwa higiena rąk, nie są wystarczające do powstrzymania zakażeń związanych z opieką zdrowotną [12]. Dlatego w szpitalach potrzebne są dodatkowe metody odkażania.
Bezdotykowa automatyczna dezynfekcja (NTD) to obiecujące podejście do zmniejszenia zakażeń związanych z opieką zdrowotną. Systemy NTD oparte są na odparowanym nadtlenku wodoru (VHP), oparach nadtlenku wodoru (HPV), dwutlenku chloru, gazowym ozonie, suchej mgle nadtlenku wodoru (DMHP) lub aerozolowym nadtlenku wodoru (aHP), często uzupełnionymi kationami srebra, aerozolowym kwasem nadoctowym, czwartorzędowymi związkami amonu, światłem o wąskim widmie o wysokiej intensywności (405 nm) i pulsacyjnym ksenonowym promieniowaniem UV (PX-UV) [13,14,15]. Wśród obecnie dostępnych systemów, ultrafioletowe urządzenia świetlne PX-UV i ultrafioletowe światło-C pozwalają osiągnąć redukcję log10 zawartości patogenu 2–4, systemy aHP ≤ 4, natomiast redukcja log10 większa niż sześć jest zgłaszana dla dwutlenku chloru parowego, VHP na bazie nadtlenku wodoru, HPV i podwójnych systemów peroksonowych [16,17,18]. Chemiczne NTD przedstawiono na rysunku 1. Ze wszystkich systemów NTD szczególnie interesujące są technologie oparte na zaawansowanych procesach utleniania. Nadtlenek wodoru jest silnym utleniaczem, wykazującym silniejsze działanie biobójcze w postaci pary niż w aerozolu [15]. W zaawansowanych technologiach utleniania nadtlenek wodoru łączy się z ozonem w celu wytworzenia peroksonu – bardzo silnego związku utleniającego [19].
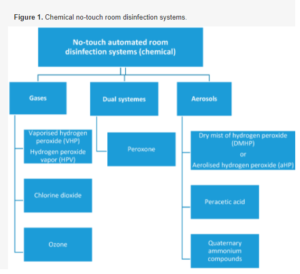
Dane dotyczące wydajności systemów NTD opartych na peroksonie w warunkach szpitalnych są ograniczone. Dlatego oceniliśmy skuteczność systemu NTD w odkażaniu krytycznych powierzchni w różnych salach szpitalnych za pomocą dwóch metod: klasycznego testu mikrobiologicznego – wymagającego czasu na uzyskanie wyników wzrostu bakterii – oraz szybkiego testu bioluminescencji ATP.
- Materiał i metody
2.1. Projekt badania i pobieranie próbek
Badanie to przeprowadzono w szpitalu onkologicznym w Polsce. Zanieczyszczenie pięciu różnych powierzchni w 10 salach szpitalnych (patrz Tabela 1) mierzono przed i po NTD za pomocą testu bioluminescencji ATP i testu mikrobiologicznego. Próbki do obu testów zostały pobrane w różne dni we wrześniu 2019 r.
Tabela 1. Zanieczyszczenie powierzchni przed i po bezdotykowej dezynfekcji w różnych pomieszczeniach szpitalnych.
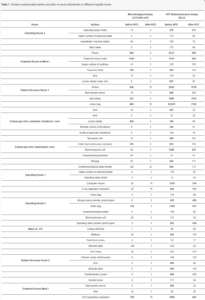
Zgodnie z instrukcjami producenta, przed NTD wszystkie sale szpitalne były czyszczone i dezynfekowane dwoma rodzajami roztworu czyszczącego: 55% etanol + czwartorzędowy propionian amonu – dla małych powierzchni (uchwyty, stoły, sprzęt medyczny itp.) oraz N-(3-aminopropylo)-N-dodécylopropano-1,3-diamina + chlorek dodecylodimetyloamonowy – dla dużych powierzchni (podłóg). Próbki pobrano do 15 minut po wstępnym czyszczeniu.
W przypadku NTD zastosowaliśmy system, który rozpyla parę peroksonu, połączenie nadtlenku wodoru i ozonu, w celu odkażenia wszystkich powierzchni.
Czas trwania dekontaminacji wynosił za każdym razem jedną godzinę. Cykl odkażania składał się z następujących faz: fazy nadtlenku wodoru, fazy ozonowej, w której powstał perokson, oraz jednogodzinnej fazy kontaktu. Następnie pokoje były napowietrzane przez kolejną godzinę.
Właściwości techniczne systemu NTD zastosowanego w badaniu były następujące:
Zastosowanie środka dezynfekującego: 8 ml/m3
Wielkość cząstek generowanych przez urządzenie: 5–8 μm (sucha mgła)
Stężenie nadtlenku wodoru: 7,5%
Maksymalne stężenie ozonu: 3 ppm
Czas kontaktu — 1 godz.
Czas napowietrzania – 1 h.
Wytyczne dla użytkowników systemu NTD surowo zabraniają obecności ludzi podczas procedury. W naszym badaniu, zgodnie z wytycznymi, podczas zabiegu NTD pomieszczenia były puste. Personel został dopuszczony do pomieszczeń po 2 godzinach, kiedy stężenie nadtlenku wodoru osiągnęło poziom poniżej 1 ppm. Próbki pobrano natychmiast po napowietrzaniu (tj. 2 h po utworzeniu peroksonu).
2.2. Testy bioluminescencji ATP
Testy bioluminescencyjne ATP wykazują ogólne zanieczyszczenie organiczne, takie jak bakterie, żywność lub ludzkie wydzieliny i wydaliny [20]. Testy te opierają się na właściwościach chemiluminescencyjnych odczynnika lucyferyna-lucyferazy, który emituje światło w obecności ATP [21]. Do pobierania próbek powierzchni użyliśmy wacików 3M Clean-Trace ATP Surface Test (3M Company, St. Paul, MN, USA), zgodnie z zaleceniami producenta. Wszystkie powierzchnie były wymazywane przez 30 s, a wymazy zostały zwrócone do urządzenia do wymazów. Testy ATP odczytano natychmiast lub w ciągu 1 godziny od pobrania. Próbki analizowano za pomocą luminometru 3M Clean-Trace NGi Luminometer (3M Company, St. Paul, MN, USA), a wyniki przedstawiono w jednostkach światła względnego (RLU). W warunkach szpitalnych RLU > 250 jest uważany za niedopuszczalne zanieczyszczenie [22].
2.3. Test mikrobiologiczny
Ze względu na fakt, że większość powierzchni ocenianych w naszym badaniu nie była płaska, zdecydowaliśmy się na zastosowanie płyt Petrifilm™ 3M™ (Londyn, ON, Kanada) [23]. Każda płytka (powierzchnia styku 20 cm2) zawierała wbudowaną siatkę ułatwiającą liczenie kolonii, rozpuszczalny w wodzie środek żelujący, składniki odżywcze i wskaźnik czerwonego barwnika. Szczegółowy skład medium nie został dostarczony przez producenta. W celu zneutralizowania środków dezynfekujących stosowanych podczas wstępnej fazy czyszczenia, każdą płytkę nawodniono 1 cm3 sterylnego neutralizatora dezynfekującego: bulion 1000 cm3, Tween 80 30,0 g, lecytynę sojową 3,0 g, L-histydynę 1,0 g, tiosiarczan 0,5 g. Po nawodnieniu płytki pozostawiono na 1 h w temperaturze pokojowej i powstał żel.
Podczas pobierania próbek płytki były dociskane na każdej powierzchni (500 g/cm2) przez 10 s, bez ruchów bocznych. Płytki inkubowano w temperaturze 37 °C przez 48 godzin w warunkach tlenowych. Następnie wzrost mikroorganizmów mierzono w jednostkach tworzących kolonie (CFU) na 100 cm2 [24]. Wartości >100 jtk/100 cm2 uznano za niedopuszczalne zanieczyszczenie.
2.4. Analiza statystyczna
Wartości z dwóch testów przedstawiono dla wszystkich powierzchni przed i po NTD. Zastosowaliśmy następujące wartości graniczne dla niezaakceptowanego zanieczyszczenia: ≥250 RLU w teście ATP i >100 CFU/100 cm2 w teście mikrobiologicznym. Test McNemara z korekcją ciągłości został wykorzystany do oceny, czy NTD znacznie zmniejszył liczbę powierzchni z niedopuszczalnym zanieczyszczeniem. Test Wilcoxona wykorzystano do porównania różnic w medianie zanieczyszczeń przed i po NTD. p < 0,05 uznano za istotną. Oprogramowanie R (wersja 3.52, R Foundation for Statistical Computing, Wiedeń, Austria) zostało użyte do wszystkich obliczeń.
- Wyniki
Łącznie przetestowano 50 powierzchni z 10 pomieszczeń. Wyniki przedstawiono na rysunku 2 i w tabeli 1, w której niedopuszczalne zanieczyszczenie jest pokazane pogrubioną czcionką.
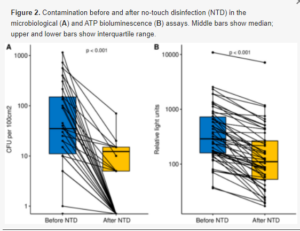
Ryc. 2. Zanieczyszczenie przed i po dezynfekcji bezdotykowej (NTD) w testach mikrobiologicznych (A) i atp bioluminescencji (B). Środkowe paski pokazują medianę; górne i dolne paski pokazują zakres międzykwartylowy.
3.1. Oznaczenie mikrobiologiczne
Przed NTD wykryto niedopuszczalne zanieczyszczenie na 11 z 50 powierzchni. Zanieczyszczenie było dopuszczalne na wszystkich badanych powierzchniach w Sali Leoperacyjnej Pacjenta nr 2, Sali Operacyjnej 1 i Oddziale nr 116. Największe zanieczyszczenie (1150 jtk/100 cm2) wykryto na oprawce lampy zabiegowej. Po NTD zanieczyszczenie było dopuszczalne na wszystkich powierzchniach we wszystkich pomieszczeniach. Największe zanieczyszczenie (70 jtk/100 cm2) wykryto przez telefon w sali pooperacyjnej pacjenta. NTD znacznie zmniejszyło liczbę powierzchni z niedopuszczalnym zanieczyszczeniem mierzoną testem mikrobiologicznym: z 11/50 do 0/50 (p < 0,001). Podobnie, zmniejszenie mediany zanieczyszczenia na wszystkich powierzchniach było również znaczące (p < 0,001, rysunek 2A).
3.2. Test bioluminescencji ATP
Przed NTD wykryto niedopuszczalne zanieczyszczenie na 28 z 50 powierzchni. Żadne z pomieszczeń nie miało dopuszczalnego zanieczyszczenia na wszystkich powierzchniach. Największe zanieczyszczenie wykryto na telefonie w sali operacyjnej 4 (2331 RLU), telefonie w sali pooperacyjnej pacjenta 1 (2552 RLU) i torbie Ambu w sali odzyskiwania pacjenta 1 (10 874 RLU). Po NTD wykryto dopuszczalne zanieczyszczenie na wszystkich powierzchniach w Zakładzie Endoskopii Oddziału nr 116 oraz w Sali Rekonwalescencji Pacjenta nr 2. Największe zanieczyszczenie wykryto na telefonie (1178 RLU), poręczy łóżka (1119 RLU) i torbie Ambu w Sali Odzyskiwania Pacjenta 1 (7123 RLU). NTD zmniejszyło, nieznacznie, częstotliwość powierzchni z niedopuszczalnym zanieczyszczeniem mierzoną testem bioluminescencji ATP: z 28/50 do 13/50 (p = 0,176). Jednak zmniejszenie mediany zanieczyszczenia na wszystkich powierzchniach było znaczące (p < 0,001, rysunek 2B).
- Dyskusja
System NTD zastosowany w tym badaniu zmniejszył zanieczyszczenie mikrobiologiczne w różnych salach szpitalnych. NTD znacznie zmniejszyło liczbę powierzchni z niedopuszczalnym zanieczyszczeniem mierzoną za pomocą testu mikrobiologicznego, ale nie za pomocą testu bioluminescencji ATP.
Skuteczność odkażania zależała od danej powierzchni. Na niektórych powierzchniach zanieczyszczenie mierzone testem ATP zmniejszyło się tylko nieznacznie po NTD – na przykład na uchwycie lampy operacyjnej (379 vs 371 RLU) lub klawiaturze aparatu rentgenowskiego (854 vs 751 RLU). Na innych powierzchniach, takich jak pilot zdalnego sterowania, zanieczyszczenie znacznie się zmniejszyło (495 w porównaniu z 25 RLU). Takie różnice mogą być związane z rodzajem materiału odkażonej powierzchni. W badaniu Eschlbecka i in. [25] zaobserwowano, że szybkość odkażania nadtlenkiem wodoru zależała od hydrofobowości materiału, podczas gdy jego porowatość odgrywała niewielką rolę. Również ilość środka stosowanego w NTD może wpływać na skuteczność procesu, jak wykazano w badaniu Horna i Niemeyera [26], w którym lepsze wyniki osiągnięto poprzez zwiększenie objętości kwasu nadoctowego.
W naszym badaniu liczba powierzchni z niedopuszczalnym zanieczyszczeniem mikrobiologicznym przed NTD była znacznie wyższa, gdy oceniano ją za pomocą testu bioluminescencji ATP niż testu mikrobiologicznego (28 w porównaniu z 11 powierzchniami). Największe zanieczyszczenie zmierzone testem mikrobiologicznym przekroczyło dopuszczalny poziom ponad 11-krotnie (oprawka lampy zabiegowej, 1150 jtk/100 cm2), a dla testu bioluminescencyjnego ATP ponad 43-krotnie (worek ambu, 10 874 RLU). Po odkażeniu systemem NTD liczba powierzchni z niedopuszczalnym zanieczyszczeniem była nadal znacznie wyższa, gdy mierzono ją za pomocą testu bioluminescencji ATP niż za pomocą testu mikrobiologicznego (13 vs 0).
W kilku badaniach porównano bioluminescencję ATP i testy mikrobiologiczne. W badaniu oceniającym ponad 80 różnych powierzchni, test mikrobiologiczny wykazał niedopuszczalne zanieczyszczenie na około 20% powierzchni przed czyszczeniem i na około 6% po czyszczeniu; odpowiednie dane liczbowe dla testu ATP były znacznie wyższe: odpowiednio 50 % i 20 % [27]. W innym badaniu oceniającym skutki dekontaminacji odparowanym nadtlenkiem wodoru, standardowy test mikrobiologiczny, ale nie test bioluminescencji ATP, wykazał wielokrotną redukcję logarytmiczną zanieczyszczenia [28]. Badacze ci doszli do wniosku, że test bioluminescencji ATP nie powinien być alternatywą dla standardowych metod mikrobiologicznych [28]. Nasze badanie jest zgodne z tymi odkryciami. Rzeczywiście, w przeglądzie Nante i in. [29], z 14 artykułów oceniających korelację między RLU a liczbą kolonii tlenowych (ACC), trzy badania nie wykazały korelacji, a cztery z nich wykazały tylko słabą / umiarkowaną korelację. Ponieważ jednak dostępne są różne testy ATP bez znormalizowanego progu, porównania między badaniami są trudne. Należy zauważyć, że nowa norma EN 17272:2020 została zatwierdzona przez Komitet Techniczny 216 Europejskiego Komitetu Normalizacyjnego (CEN/TC 216), opisująca metody określania aktywności dezynfekującej zautomatyzowanych procesów dystrybucji chemikaliów przez dyfuzję powietrzną [30]. Ujednolicony standard zapewni wytyczne dla przyszłych badań, dzięki czemu przyszłe badania będą bardziej porównywalne.
Testy ATP nie są optymalne do szacowania ryzyka infekcji. Testy te nie pozwalają odróżnić bakterii chorobotwórczych i niepatogennych oraz żywych i martwych komórek. Związek między poziomem resztkowego zanieczyszczenia powierzchni a ryzykiem zakażenia po konwencjonalnej dezynfekcji nie został szeroko zbadany. Jednak wiele badań wykazało, że kolejni pacjenci zajmujący salę szpitalną po zakażonych osobach są narażeni na zwiększone ryzyko zakażenia [31,32,33,34,35]. Prawdopodobnie konwencjonalne metody nie zapobiegają w wystarczającym stopniu przenoszeniu chorób. Bshabshe i in. [36] wykazali, że NTD może zmniejszyć to ryzyko. W innym badaniu Anesi i in. [37] zaobserwowali zmniejszenie częstości występowania Clostridioides (Clostridium) z 1,73 do 0,93 przypadków na 1000 pacjento-dni w ciągu 12 miesięcy po wdrożeniu NTD. Będąc szczególnie cennym w przypadku dużego przeciążenia pacjentów, gdy ryzyko przeniesienia choroby jest wysokie, systemy NTD zostały zalecane w leczeniu pandemii SARS-CoV-2 [38].
Oceniając skuteczność metod czyszczenia i odkażania, należy zwrócić szczególną uwagę na potencjalne błędy ludzkie, np. niewłaściwe sformułowanie lub czas kontaktu środka, pominięcie obszaru wrażliwego itp. [39]. Systemy NTD eliminują wpływ czynnika ludzkiego. Nasze badanie jest zgodne z innymi badaniami [40] potwierdzającymi, że NTD może skutecznie dezaktywować patogenne mikroorganizmy, podczas gdy konwencjonalne metody pozostają niewystarczające.
Należy wspomnieć o ograniczeniach naszego badania. Po pierwsze, wielkość próby, tj. liczba ocenianych powierzchni i sal szpitalnych, była niewielka. Po drugie, związki chemiczne stosowane w naszym badaniu przed NTD mogą zakłócać testy oparte na ATP [41]. Nie zidentyfikowaliśmy również gatunków występujących w badanych pomieszczeniach przed i po zastosowaniu systemu NTD. Jakościowe metody oceny byłyby szczególnie cenne w ocenie ryzyka hai przed i po dekontaminacji, jednak metody ilościowe wydają się wspierać skuteczność systemu NTD, ponieważ zmniejsza on poziomy zanieczyszczenia poniżej norm powszechnie stosowanych w warunkach klinicznych.
Wreszcie, w testach mikrobiologicznych zastosowaliśmy wartość >100 jtk/100 cm2 jako próg niedopuszczalnego zanieczyszczenia, co nie jest powszechne w innych badaniach. Niektórzy autorzy sugerują dla klinicznych ocen higieny powierzchni taki sam próg jak dla przemysłu spożywczego (>250 jtk/100 cm2) [42]. Norma ta została wdrożona w wielu badaniach [43,44,45,46]; nie jest jednak jasne, czy jest ona odpowiednia do zapobiegania przenoszeniu chorób w placówkach opieki zdrowotnej [47]. Dlatego zdecydowaliśmy się na zastosowanie bardziej rygorystycznej normy [24]. Według Carlinga i in. [48] tylko powierzchnie z niewykrywalnymi poziomami zanieczyszczenia biologicznego (0 CFU) osiągniętymi po udokumentowanym czyszczeniu można uznać za skutecznie odkażone.
- Wnioski
Podsumowując, nasze badanie wykazało, że NTD jest wykonalną metodą odkażania: po dodaniu do standardowych procedur odkażania może jeszcze bardziej zmniejszyć ryzyko zakażeń związanych z opieką zdrowotną. Wydaje się, że testy bioluminescencyjne ATP ze standardowym odcięciem nie są ważne do oceny skuteczności NTD. Konieczne są dalsze badania w celu standaryzacji wartości granicznych.
Wkład autora
Konceptualizacja, P.T., A.N.-O.; metodologia, P.T.; oprogramowanie, P.T.; walidacja, P.T.; analiza formalna, P.T.; dochodzenie, P.T.; zasoby, P.T.; kuracja danych, P.T.; pisanie – przygotowanie oryginalnego szkicu, P.T.; pisanie – recenzja i redakcja, A.N.-O.; wizualizacja, P.T.; nadzór, A.N.-O.; administracja projektów, P.T.; pozyskiwanie finansowania, P.T. Wszyscy autorzy przeczytali i zgodzili się na opublikowaną wersję manuskryptu.
Finansowania
Badania te nie otrzymały finansowania zewnętrznego.
Podziękowania
Autorzy chcieliby podziękować firmie Amity International za bezpłatne dostarczenie instrumentu AirdeconTM 200 do eksperymentów.
Konflikty interesów
Autorzy deklarują brak konfliktu interesów.
Klevens, R.M.; Edwards, J.R.; Richards, C.L. Estimating healthcare-associated infections and deaths in U.S. hospitals, 2002. Public Health Rep. 2007, 122, 160–166. [Google Scholar] [CrossRef] Anderson, R.N. Deaths: Leading causes for 1999. Natl. Vital. Stat. Rep. 2001, 49, 1–87. [Google Scholar] [PubMed] Cassini, A.; Plachouras, D.; Eckmanns, T.; Sin, M.A.; Blank, H.-P.; Ducomble, T.; Haller, S.; Harder, T.; Klingeberg, A.; Sixtensson, M.; et al. Burden of Six Healthcare-Associated Infections on European Population Health: Estimating Incidence-Based Disability-Adjusted Life Years through a Population Prevalence-Based Modelling Study. PLoS Med. 2016, 13, e1002150. [Google Scholar] [CrossRef] [PubMed] Scott, R., II. The Direct Medical Costs of Healthcare-Associated Infections in US Hospitals and the Benefits of Prevention. In Division of Healthcare Quality Promotion, National Center for Preparedness, Detection, and Control of Infectious Diseases, Coordinating Center for Infectious Diseases, Centers for Disease Control and Prevention; Polock, D.A., Stone, P.W., Eds.; Economist: London, UK, 2009. [Google Scholar] Kramer, A.; Schwebke, I.; Kampf, G. How long do nosocomial pathogens persist on inanimate surfaces? A systematic review. BMC Infect. Dis. 2006, 6, 130. [Google Scholar] [CrossRef] Sole, M.L.; Poalillo, F.E.; Byers, J.F.; Ludy, J.E. Bacterial growth in secretions and on suctioning equipment of orally intubated patients: A pilot study. Am. J. Crit. Care 2002, 11, 141–149. [Google Scholar] [CrossRef] Catalano, M.; Quelle, L.S.; Jeric, P.E.; Di Martino, A.; Maimone, S.M. Survival of Acinetobacter baumannii on bed rails during an outbreak and during sporadic cases. J. Hosp. Infect. 1999, 42, 27–35. [Google Scholar] [CrossRef] [PubMed] Heyba, M.; Ismaiel, M.; Alotaibi, A.; Mahmoud, M.; Baquer, H.; Safar, A.; Al-Sweih, N.; Al-Tailr, A. Microbiological contamination of mobile phones of clinicians in intensive care units and neonatal care units in public hospitals in Kuwait. BMC Infect. Dis. 2015, 15, 434. [Google Scholar] [CrossRef] [PubMed] Hartmann, B.; Benson, M.; Junger, A.; Quinzio, L.; Rohring, R.; Fengler, B.; Farber, U.W.; Wille, B.; Hempelmann, G. Computer keyboard and mouse as a reservoir of pathogens in an intensive care unit. J. Clin. Monit. Comput. 2004, 18, 7–12. [Google Scholar] [CrossRef] Sievert, D.M.; Ricks, P.; Edwards, J.R.; Schneider, A.; Patel, J.; Srinivasan, A.; Kallen, A.; Limbago, B.; Fridkin, S.F. National Healthcare Safety Network (NHSN) Team and Participating NHSN Facilities. Antimicrobial-resistant pathogens associated with healthcare-associated infections: Summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009–2010. Infect. Control Hosp. Epidemiol. 2013, 34, 1–14. [Google Scholar] Hidron, A.I.; Edwards, J.R.; Patel, J.; Horan, T.C.; Sievert, D.M.; Pollock, D.A.; Fridkin, S.F. National Healthcare Safety Network Team; Participating National Healthcare Safety Network Facilities. Infections: Annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006–2007. Infect. Control Hosp. Epidemiol. 2008, 29, 996–1011. [Google Scholar] [CrossRef] Wilson, A.P.R.; Smyth, D.; Moore, G.; Singleton, J.; Jackson, R.; Gant, V.; Jeanes, A.; Shaw, S.; James, E.; Cooper, B.; et al. The impact of enhanced cleaning within the intensive care unit on contamination of the near-patient environment with hospital pathogens: A randomized crossover study in critical care units in two hospitals. Crit. Care Med. 2011, 39, 651–658. [Google Scholar] [CrossRef] [PubMed] Dancer, S.J. Controlling hospital-acquired infection: Focus on the role of the environment and new technologies for decontamination. Clin. Microbiol. Rev. 2014, 27, 665–690. [Google Scholar] [CrossRef] [PubMed] Han, J.H.; Sullivan, N.; Leas, B.F.; Pegues, D.A.; Kaczmarek, J.L.; Umscheid, C.A. Cleaning Hospital Room Surfaces to Prevent Health Care-Associated Infections: A Technical Brief. Ann. Intern. Med. 2015, 20, 598–607. [Google Scholar] [CrossRef] [PubMed] Otter, J.A.; Yezli, S.; Perl, T.M.; Barbut, F.; French, G.L. 17—A guide to no-touch automated room disinfection (NTD) systems. In Decontamination in Hospitals and Healthcare; Woodhead Publishing Limited: Cambridge, UK, 2014; pp. 413–460. [Google Scholar] Casini, B.; Tuvo, B.; Cristina, M.L.; Spagnolo, A.M.; Totaro, M.; Baggiani, A.; Privitera, G.P. Evaluation of an ultraviolet C (UVC) light-emitting device for disinfection of high touch surfaces in hospital critical areas. Int. J. Environ. Res. Public Health 2019, 16, 3572. [Google Scholar] [CrossRef] [PubMed] Elgujja, A.; Altalhi, H.; Ezreqat, S. Review of the efficacy of ultraviolet C for surface decontamination. J. Nat. Sci. Med. 2020, 3, 8–12. [Google Scholar] [CrossRef] Otter, J.A.; Yezli, S.; Perl, T.M.; Barbut, F.; French, G.L. The role of “no-touch” automated room disinfection systems in infection prevention and control. J. Hosp. Infect. 2013, 83, 1–13. [Google Scholar] [CrossRef] Xu, X.; Goddard, W.A., III. Peroxone chemistry: Formation of H2O3 and ring-(HO2) (HO3) from O3/H2O2. Proc. Natl. Acad. Sci. USA 2002, 99, 15308–15312. [Google Scholar] [CrossRef] Moore, G.; Smyth, D.; Singleton, J.; Wilson, P. The use of adenosine triphosphate bioluminescence to assess the efficacy of a modified cleaning program implemented within an intensive care setting. Am. J. Infect. Control 2010, 38, 617–662. [Google Scholar] [CrossRef] Shama, G.; Malik, D. The uses and abuses of rapid bioluminescence-based ATP assays. Int. J. Hydrogen Environ. Health 2013, 216, 115–125. [Google Scholar] [CrossRef] European Committee for Standardization. CEN/TC 243—Cleanroom Technology. 1993. Available online: https://standards.iteh.ai/catalog/tc/cen/9f58539c-5394-4f44-afe3-8528a2e35e33/cen-tc-243 (accessed on 1 May 2020).
Rawlinson, S.; Ciric, L.; Cloutman-Green, E. How to carry out microbiological sampling of healthcare environment surfaces? A review of current evidence. J. Hosp. Inf. 2019, 103, 363–374. [Google Scholar] [CrossRef] Draft European Standard CEN/TC/243/WG2/1993. Available online: https://www.hex-group.eu/en_BE/biocontamination-control/ (accessed on 1 May 2020).
Eschlbeck, E.; Seeburger, C.; Kulozik, U. Spore inactivation on solid surfaces by vaporized hydrogen peroxide—Influence of carrier material surface properties. J. Food. Sci. 2020. [Google Scholar] [CrossRef] [PubMed] Horn, H.; Niemeyer, B. Aerosol disinfection of bacterial spores by peracetic acid on antibacterial surfaces and other technical materials. Am. J. Infect. Control 2020. [Google Scholar] [CrossRef] [PubMed] Huang, Y.S.; Chen, Y.C.; Chen, M.L.; Cheng, A.; Hung, I.C.; Wang, J.T.; Sheng, W.H.; Chang, S.C. Comparing visual inspection, aerobic colony counts, and adenosine triphosphate bioluminescence assay for evaluating surface cleanliness at a medical center. Am. J. Infect. Control. 2015, 43, 882–886. [Google Scholar] [CrossRef] [PubMed] Colbert, M.E.; Gibbs, S.G.; Schmid, K.K.; High, R.; Lowe, J.J.; Chaika, O.; Smith, P.W. Evaluation of adenosine triphosphate (ATP) bioluminescence assay to confirm surface disinfection of biological indicators with vaporised hydrogen peroxide (VHP). Healthc. Infect. 2015, 20, 16–22. [Google Scholar] [CrossRef] Nante, N.; Ceriale, E.; Messina, G.; Lenzi, D.; Manzi, P. Effectiveness of ATP bioluminescence to assess hospital cleaning: A review. J. Prev. Med. Hyg. 2017, 58, E177–E183. [Google Scholar] EN 17272:2020. Chemical Disinfectants and Antiseptics—Methods of Airborne Room Disinfection by Automated Process —Determination of Bactericidal, Mycobactericidal, Sporicidal, Fungicidal, Yeasticidal, Virucidal and Phagocidal Activities. Available online: https://standards.cen.eu/dyn/www/f?p=204:110:0::::FSP_LANG_ID,FSP_PROJECT:25,62318&cs=10D54BE215B9679AD9914C42C71BA77CE (accessed on 1 May 2020).
Weber, D.J.; Rutala, W.A.; Miller, M.B.; Huslage, K.; Sickbert-Bennett, E. Role of hospital surfaces in the transmission of emerging health care-associated pathogens: Norovirus, Clostridium difficile, and Acinetobacter species. Am. J. Infect. Control 2010, 38, S25–S33. [Google Scholar] [CrossRef] Datta, R.; Platt, R.; Yokoe, D.S.; Huang, S.S. Environmental cleaning intervention and risk of acquiring multidrug-resistant organisms from prior room occupants. Arch. Intern. Med. 2011, 171, 491–494. [Google Scholar] [CrossRef] Huang, S.S.; Datta, R.; Platt, R. Risk of acquiring antibiotic-resistant bacteria from prior room occupants. Arch. Intern. Med. 2006, 166, 1945–1951. [Google Scholar] [CrossRef] Drees, M.; Snydman, D.; Schmid, C. Prior environmental contamination increases the risk of acquisition of vancomycin-resistant enterococci. Clin. Infect. Dis. 2008, 46, 678–685. [Google Scholar] [CrossRef] Nseir, S.; Blazejewski, C.; Lubret, R.; Wallet, F.; Courcol, R.; Durocher, A. Risk of acquiring multidrug-resistant Gram-negative bacilli from prior room occupants in the ICU. Clin. Microbiol. Infect. 2011, 17, 1201–1208. [Google Scholar] [CrossRef] Bshabshe, A.A.; Joseph, M.R.P.; Assiri, A.; Omer, H.A.; Hamid, M.E. A multimodality approach to decreasing ICU infections by hydrogen peroxide, silver cations, and compartmentalization. J. Infect. Public Health 2020. [Google Scholar] [CrossRef] [PubMed] Anesi, A.; Rognoni, V.; Accetta, R.; Ferrari, M. Impact of hydrogen peroxide and silver cations dry-mist disinfection on the reduction of hospital acquired Clostridium difficile infections. In Proceedings of the 28th European Congress of Clinical Microbiology and Infectious Diseases, Madrid, Spain, 21–24 April 2018. [Google Scholar] Fudan Zhongshan. Guidance of COVID-19 Prevention and Control. Available online: https://www.tencent.com/en-us/responsibility/combat-covid-19-hospital-guidance.html (accessed on 1 May 2020).
Carling, P.C.; Von Beheren, S.; Kim, P.; Woods, C. Healthcare Environmental Hygiene Study Group. Intensive care unit environmental cleaning: An evaluation in sixteen hospitals using a novel assessment tool. J. Hosp. Infect. 2008, 68, 39–44. [Google Scholar] [CrossRef] [PubMed] Chiguer, M.; Maleb, A.; Amrani, R.; Abda, N.; Alami, Z. Assessment of surface cleaning and disinfection in neonatal intensive care unit. Heliyon 2019, 5, E2966. [Google Scholar] [CrossRef] Brown, E.; Eder, A.R.; Thompson, K.M. Do surface and cleaning chemistries interfere with ATP measurement systems for monitoring patient room hygiene? J. Hosp. Infect. 2010, 74, 193–195. [Google Scholar] [CrossRef] [PubMed] Dancer, S.J. How do we assess hospital cleaning? A proposal for microbiological standards for surface hygiene in hospitals. J. Hosp. Infect. 2004, 56, 10–15. [Google Scholar] [CrossRef] [PubMed] Lewis, T.; Griffith, C.; Gallo, M.; Weinbren, M. A modified ATP benchmark for evaluating the cleaning of some hospital environmental surfaces. J. Hosp. Infect. 2008, 69, 156–163. [Google Scholar] [CrossRef] Mulvey, D.; Redding, P.; Robertson, C.; Woodall, C.; Kingsmore, P.; Bedwell, D.; Dancer, S.J. Finding a benchmark for monitoring hospital cleanliness. J. Hosp. Infect. 2011, 77, 25–30. [Google Scholar] [CrossRef] Smith, P.W.; Sayles, H.; Hewlett, A.; Cavalieri, R.J.; Gibbs, S.G.; Rupp, M.E. A study of three methods for assessment of hospital environmental cleaning. Healthc. Infect. 2013, 18, 80–85. [Google Scholar] [CrossRef] Ho, Y.H.; Wang, L.S.; Jiang, H.L.; Chang, C.H.; Hsieh, C.J.; Chang, D.C.; Tu, H.Y.; Chiu, T.Y.; Chao, H.J.; Tseng, C.C. Use of a Sampling Area-Adjusted Adenosine Triphosphate Bioluminescence Assay Based on Digital Image Quantification to Assess the Cleanliness of Hospital Surfaces. Int. J. Environ. Res. Public. Health. 2016, 13, 576. [Google Scholar] [CrossRef] Griffith, C.J.; Obee, P.; Cooper, R.A.; Burton, N.F.; Lewis, M. The effectiveness of existing and modified cleaning regimens in a Welsh hospital. J. Hosp. Infect. 2007, 66, 352–359. [Google Scholar] [CrossRef] Carling, P.C.; Perkins, J.; Ferguson, J.; Thomasser, A. Evaluating a New Paradigm for Comparing Surface Disinfection in Clinical Practice. Infect. Control. Hosp. Epidemiol. 2014, 35, 1349–1355. [Google Scholar] [CrossRef] [PubMed]© 2020 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/).



















