Artykuł z MDPI https://www.mdpi.com/1660-4601/17/14/5131/htm#
Nie odpowiadamy za tłumaczenie ale zachęcamy do lektury.
Bezdotykowa automatyczna dezynfekcja pomieszczeń po sekcjach zwłok ekshumowanych
Autor: Patryk Tarka 1,* ORCID,Aleksandra Borowska-Solonynko 2ORCID,Małgorzata Brzozowska 2ORCID,Aneta Nitsch-Osuch 1ORCID,Krzysztof Kanecki 1ORCID,Robert Kuthan 3ORCID iBara Garczewska 4
1Zakład Medycyny Społecznej i Zdrowia Publicznego; Warszawski Uniwersytet Medyczny, ul. Oczki 3, 02-007 Warszawa, Polska
2Klinika Medycyny Sądowej, Warszawski Uniwersytet Medyczny, ul. Oczki 1, 02-007 Warszawa
3Katedra i Zakład Mikrobiologii Medycznej, Warszawski Uniwersytet Medyczny, ul. Chalubińskiego 5, 02-004 Warszawa
4Pracownia Mykologii, Instytut Gruźlicy i Chorób Płuc, ul. Płocka 26, 01-138 Warszawa
*
Autor, do którego należy kierować korespondencję.
Patogeny 2020, 9(8), 648; https://doi.org/10.3390/pathogens9080648
Otrzymano: 10 czerwca 2020 r. / Zaktualizowano: 30 lipca 2020 r. / Zaakceptowano: 6 sierpnia 2020 r. / Opublikowano: 12 sierpnia 2020 r.
(Ten artykuł należy do sekcji Ludzkie patogeny)
Abstrakt
Autopsje ekshumowanych ciał stwarzają ryzyko zakażeń bakteriami środowiskowymi lub grzybami, które mogą zagrażać życiu. Dlatego ważne jest stosowanie skutecznych metod dezynfekcji w placówkach patologii sądowej. W tym badaniu zbadaliśmy skuteczność bezdotykowego zautomatyzowanego systemu dezynfekcji (NTD) po autopsjach ekshumowanych ciał. Bezpośrednio po 11 autopsjach ekshumowanych ciał zastosowaliśmy system NTD oparty na oparach peroksonu do dezynfekcji powietrza i powierzchni. Zmierzyliśmy obciążenie mikrobiologiczne w powietrzu i na powierzchniach przed i po NTD. System NTD zmniejszył średnie obciążenie bakteryjne w powietrzu ze 171 jednostek tworzących kolonie (CFU)/m3 do 3CFU/m3. Średnie obciążenie grzybami w powietrzu zmniejszyło się z 221 jtk/m3 do 9CFU/m3. Średnie obciążenie mikrobiologiczne na całej powierzchni wynosiło 79 jtk / 100 cm2 po wszystkich autopsjach i zmniejszyło się do 2 jtk / 100 cm2 po NTD. Podsumowując, system NTD oparty na peroksonie był skuteczny w odkażaniu powietrza i powierzchni w pomieszczeniu do sekcji po autopsjach ekshumowanych ciał.
Słowa kluczowe: sekcja zwłok; ciało ekshumowane; bezdotykowa dezynfekcja pomieszczeń
- Wprowadzenie
Patolodzy sądowi są narażeni na zwiększone ryzyko różnych zakażeń, szczególnie tych związanych z wirusami hepatotropowymi, koronawirusami, meningokokami lub Mycobacterium tuberculosis [1,2,3,4,5]. Ponadto autopsje ekshumowanych ciał stwarzają szczególne ryzyko zakażeń patogennymi szczepami bakterii lub grzybów z rozkładających się ciał lub środowiska, które mogą zagrażać życiu nawet u osób immunokompetentnych [5,6]. Na przykład Aspergillus flavus, często spotykany w zwłokach, może powodować śmiertelną inwazyjną aspergilozę [6,7]. Społeczność bakterii, grzybów lub innych organizmów kolonizujących zwłoki nazywana jest nekrobiomem [8]. Nekrobiom może zawierać Eurotium repens, wyizolowany z powierzchni skóry i kości zwłok [9] oraz pleśnie takie jak Penicillium oxalicum i Cladosporium colocasiae, wyizolowane ze zwłok zachowanych w niskich procentach (4%) formaldehydu [10]. Grzyby metabolizują materię organiczną in situ i zmieniają zarówno jej właściwości biochemiczne i fizykochemiczne, jak i strukturę społeczności drobnoustrojów [11]. Patogeny mogą być nabyte przez wdychanie (kropelki, pył powietrzny, aerozol wytwarzany podczas otwierania ciała), spożycie, bezpośredni kontakt ze skórą lub kontakt z zakażonymi powierzchniami w pomieszczeniu rozwarstwienia (wejście przez wcześniej istniejące przerwy w skórze i przez błony śluzowe oczu, nosa lub ust) [12]. Dlatego ważne jest stosowanie skutecznych metod dezynfekcji w placówkach patologii sądowej.
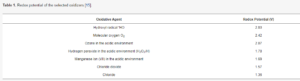
Historycznie jednym ze środków stosowanych do dezynfekcji pomieszczeń szpitalnych, laboratoriów i pomieszczeń sekcyjnych był formaldehyd. Jednak toksyczne problemy związane z formaldehydem doprowadziły do wdrożenia innych, znacznie bezpieczniejszych substancji gazowych. Szczególnie obiecująca wydaje się grupa metod opartych na zaawansowanych technologiach/procesach utleniania (AOT/AOP). Metody te obejmują ozonolizę w obecności światła UV (O3 / UV); nadtlenek wodoru i ozon (O3/H2O2), utlenianie fotokatalityczne na obecność dwutlenku tytanu (TiO2) i utlenianie układu Fentona (H2O2/Fe2+). Wspólną cechą tych metod jest tworzenie peroksonu, wysoce aktywnego biologicznie związku [13,14]. Perokson powstaje w wyniku reakcji redoks, w której odczynnikiem oksydacyjnym jest tlen i / lub jego aktywne formy, takie jak ozon, H2O2 i rodniki nadtlenkowe. W reakcjach tych dominuje mechanizm wolnych rodników, a najważniejszym produktem jest rodnik hydroksylowy •HO o wysokim potencjale redoks (2,8 V, Tabela 1).
Tabela 1. Potencjał redoks wybranych utleniaczy [15].
W opiece zdrowotnej systemy bezdotykowej automatycznej dezynfekcji (NTD) zyskują coraz większą popularność oprócz standardowej dezynfekcji powierzchni [16,17,18,19]. Zazwyczaj systemy NTD wykorzystują substancje takie jak nadtlenek wodoru lub dwutlenek chloru do automatycznej dezynfekcji całych pomieszczeń [20,21,22]. Stosuje się również zaawansowane procesy utleniania, takie jak połączenie nadtlenku wodoru z ozonem (peroksonem) [23]. Systemy NTD są skuteczne przeciwko bakteriom, wirusom i grzybom, w tym Aspergillus spp., Penicillium spp. i Fusarium spp. [24]. Jednak dostępne dane dotyczące zakażenia grzybiczego po autopsjach ekshumowanych ciał są ograniczone, podczas gdy działanie systemu NTD po autopsjach nie zostało do tej pory zbadane. W tym badaniu zbadaliśmy skuteczność systemu NTD opartego na peroksonie w odkażaniu pomieszczeń do sekcji zwłok po autopsjach ekshumowanych ciał. Zgodnie z naszą najlepszą wiedzą, jest to pierwsze badanie dotyczące skuteczności systemu NTD opartego na peroksonie w dezynfekcji po autopsjach ekshumowanych ciał.
- Wyniki
Tabela 2 przedstawia wszystkie gatunki bakterii i grzybów zidentyfikowane w badaniu. Organizmy te zostały zidentyfikowane po autopsjach za pomocą zautomatyzowanego systemu VITEK2®. Wszystkie zidentyfikowane mikroorganizmy należą do bakterii i grzybów środowiskowych.
Tabela 2. Wykaz wszystkich zidentyfikowanych organizmów.

Po autopsjach średnie obciążenie bakteryjne w powietrzu wynosiło 171 (zakres 35–263) jednostek tworzących kolonie (CFU)/m3 i zmniejszyło się do 3 (0–23) jtk/m3 po odkażeniu (ryc. 1). Średnie obciążenie grzybami w powietrzu wynosiło 221 (43–290) jtk/m3 i zmniejszyło się do 9 (0–43) jtk/m3 po odkażeniu (ryc. 1).

Ryc. 1. Obciążenie bakteryjne w powietrzu (a), obciążenie grzybicze w powietrzu (b) i obciążenie mikrobiologiczne powierzchni w pomieszczeniu do sekcji (c) po autopsjach ekshumowanych zwłok przed i po 1 godzinie bezdotykowej dekontaminacji.
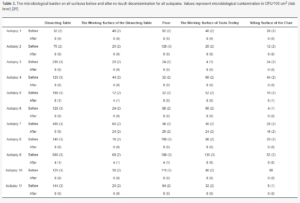
Średnie obciążenie drobnoustrojami na całej powierzchni wynosiło 79 (44-238) jtk na 100 cm2 po wszystkich autopsjach i zmniejszyło się do 2 (0-18) jtk na 100 cm2 (ryc. 1). Tabela 3 przedstawia szczegółowe dane dotyczące zanieczyszczenia dla wszystkich powierzchni wraz z odpowiednimi poziomami bezpieczeństwa. W 8 z 11 autopsji użycie systemu NTD nie spowodowało wykrycia skażenia mikrobiologicznego. W trzech pozostałych sekcjach zwłok stwierdzono zanieczyszczenie na poziomie szczątkowym 1 (dwie sekcje zwłok) i poziomie 2 (jedna sekcja zwłok) (tabela 3).
Tabela 3. Obciążenie mikrobiologiczne na wszystkich powierzchniach przed i po bezdotykowym odkażeniu dla wszystkich autopsji. Wartości reprezentują zanieczyszczenie mikrobiologiczne w jtk/100 cm2 (poziom ryzyka) [25].
- Dyskusja
Badanie to wykazało, że system NTD oparty na peroksonie był skuteczny w odkażaniu powietrza i powierzchni w pomieszczeniu do sekcji po autopsjach ekshumowanych ciał. Co ważne, system NTD skutecznie zmniejszył lub wyeliminował zarówno skażenie bakteryjne, jak i grzybicze.
Literatura dotycząca kwestii bezpieczeństwa w pomieszczeniach sekcyjnych zaleca stosowanie środków ochrony osobistej, takich jak rękawiczki, okulary lub maski podczas sekcji zwłok [2,3,4]. Obecne wytyczne dotyczące odkażania ograniczają się do czyszczenia i dezynfekcji powierzchni i narzędzi, w zależności od potencjalnego czynnika zakaźnego [26]. Niedawno opublikowano normę europejską opisującą metody dezynfekcji powierzchni nieporowatych poprzez zautomatyzowaną dystrybucję chemikaliów [27]. Dokument ten pozwoli na zastosowanie jednolitego standardu oceny i porównania skuteczności dostępnych systemów NDT.
Systemy NTD stosowane są w tzw. warunkach czystych, czyli po wstępnym czyszczeniu i dezynfekcji powierzchni. W naszym badaniu poziom zanieczyszczenia mikrobiologicznego nie był badany bezpośrednio po wstępnym oczyszczeniu podchlorynem sodu. Stwierdziliśmy jednak, że poziom mikrobiologiczny w powietrzu, w którym nie stosowano podchlorynu sodu, zmniejszył się po systemie NTD. Wstępne czyszczenie i dezynfekcja, a następnie stosowanie systemu NTD należy traktować jako podejście zintegrowane.
Dekontaminacja pomieszczeń do sekcji jest ważna dla zmniejszenia ryzyka infekcji, szczególnie po sądowych sekcjach zwłok ekshumowanych, które mogą powodować ostre zagrażające życiu choroby zakaźne. W naszym badaniu zidentyfikowaliśmy kilka potencjalnie patogennych szczepów bakterii i grzybów po autopsjach (Tabela 2); jednak obciążenie mikrobiologiczne było niskie. Zgodnie z przepisami ue liczba mikroorganizmów w powietrzu nie powinna być większa niż 500 jtk/m3 [25]. W naszym badaniu ten próg bezpieczeństwa nie został osiągnięty po autopsjach ekshumowanych ciał, nawet przed NTD. Niemniej jednak system NTD zmniejszył liczbę mikroorganizmów do jeszcze niższych poziomów. Nasze wyniki są zgodne z poprzednim badaniem, w którym do odkażania szpitalnych systemów wentylacyjnych zastosowano inny system NDS oparty na nadtlenku wodoru i kationach srebra [28]. W badaniu tym zanieczyszczenie Aspergillus fumigatus zostało wyeliminowane po dezynfekcji. W naszym badaniu obciążenie mikrobiologiczne nie było wykrywalne po zastosowaniu systemu NTD w 8 z 11 autopsji, aw pozostałych autopsjach resztkowe zanieczyszczenie mikrobiologiczne było niskie.
Zanieczyszczenie grzybami jest szczególnym problemem po autopsjach ekshumowanych ciał. Wzrost grzybów jest często widoczny na ekshumowanych ciałach, a zarodniki różnych grzybów, takich jak Aspergillus spp. i Penicillium spp. są często obecne [5,29]. Grzyby są bardzo odporne na niską wilgotność, a konidia grzybów są w stanie przetrwać kilkadziesiąt lat nawet w ciekłym azocie lub po liofilizacji [30]. Grzyby i mikotoksyny mogą powodować wiele chorób. Na przykład Aspergillus flavus jest czynnikiem etiologicznym zapalenia zatok, zapalenia rogówki lub zmian skórnych [31], a Aspergillus flavus lub Aspergillus fumigatus może powodować astmę lub alergiczne zapalenie płuc [32,33,34,35]. Ponadto Aspergillus spp. może prowadzić do stanów zagrażających życiu, takich jak śmiertelna inwazyjna aspergiloza [6,7]. W naszym badaniu zidentyfikowano zarówno Aspergillus flavus, jak i Aspergillus fumigatus. Jest to zgodne z ustaleniami Schwarza i wsp., którzy również zgłosili obecność Aspergillus fumigatus na rozłożonych ciałach [5].
Podobnie jak w przypadku raportów Schwarza i in. [5] oraz Łukaszuka i in. [6], większość grzybów zidentyfikowanych w naszym badaniu została uznana za bezpieczną (należącą do grupy ryzyka 1). Dwa izolaty grzybów zgłoszone w naszym badaniu, Cladosporium spp. i Penicillium spp., są powszechnymi saprofitami środowiskowymi. Niemniej jednak badania epidemiologiczne wykazały związek między ekspozycją na Penicillium a zwiększonym ryzykiem świszczącego oddechu, uporczywego kaszlu i wyższego wskaźnika nasilenia astmy [36]. Ponadto niektóre gatunki (sklasyfikowane jako grupa ryzyka ≤3) Cladosporium spp. i Penicillium spp., mogą stwarzać ryzyko ciężkiej choroby [37,38]. Niektóre gatunki wcześniej sklasyfikowane jako Cladosporium i Penicillium zostały ponownie sklasyfikowane jako patogeny grupy ryzyka 3, np. Cladophialophora bantiana, powodujące ciężkie infekcje ośrodkowego układu nerwowego charakteryzujące się wysoką śmiertelnością [39] i Talaromyces (Penicillium) marneffei, powodujące ciężkie głębokie infekcje. Pomimo faktu, że gatunki te są najczęściej powszechne w Tajlandii, Kambodży, tajwanie i Indiach, przypadki zakażeń tymi patogenami odnotowano również w innych regionach [40]. Obecność Cladosporium spp. i Penicillium spp. na ludzkich zwłokach wykazano wcześniej [41,42,43,44]. W przeciwieństwie do innych badań nie wykryliśmy grzybów należących do gatunków Candida, które są uznawane za prawdopodobnie alergizujące [5,44].
To badanie ma pewne ograniczenia. Po pierwsze, został on ograniczony do jednego pomieszczenia prosekcyjnego, a nasze obserwacje muszą zostać potwierdzone w innych obiektach. Do wstępnego czyszczenia użyliśmy podchlorynu sodu, a pozostały chlor może wpływać na obciążenie mikrobiologiczne w momencie oceny. Poziom zanieczyszczenia mikrobiologicznego nie był badany bezpośrednio po tej procedurze. Co więcej, użyliśmy tylko jednego urządzenia do NTD, a inne systemy dostępne na rynku wymagałyby podobnych badań. Niemniej jednak, ponieważ istnieją ograniczone dane na temat wykorzystania systemów NTD w pomieszczeniach do sekcji zwłok, nasze badanie przedstawia przydatne informacje dla placówek przeprowadzających sekcje zwłok, w szczególności kryminalistyczne.
Podsumowując, system NTD wydaje się obiecujący do odkażania pomieszczeń do sekcji zwłok po autopsjach ekshumowanych ciał. Normy dotyczące stosowania systemów NTD w prosektorium jeszcze się nie pojawiły, a do tego czasu należy przestrzegać instrukcji dostarczanych przez producentów konkretnych urządzeń.
- Materiały i metody
4.1. Projekt badania
Przeprowadziliśmy 11 sekcji zwłok ekshumowanych ciał. Zgony miały miejsce w 2010 r. w wyniku obrażeń; ekshumacje i sekcje zwłok przeprowadzono w 2018 roku. Z systemu NTD korzystaliśmy bezpośrednio po autopsjach ekshumowanych ciał. Przed zastosowaniem NTD prosektorium zostało przemyte podchlorynem sodu, zgodnie z instrukcjami producenta. Podchloryn sodu jest aktywny przeciwko bakteriom, wirusom, zarodnikom, grzybom i mikotoksynom [26]. Obciążenie mikrobiologiczne w powietrzu i na różnych powierzchniach mierzono bezpośrednio po każdej autopsji i po dekontaminacji systemem Airdecon 200TM.
4.2. Urządzenie
System Airdecon 200TM NTD (Amity International, Barnsley, Wielka Brytania) zastosowaliśmy w pomieszczeniu do sekcji o kubaturze o pojemności 78 m3. System rozpyla parę peroksonu (połączenie nadtlenku wodoru i ozonu) w celu odkażenia wszystkich powierzchni. Czas trwania dekontaminacji wynosił za każdym razem 1 h. Cykl odkażania składał się z następujących faz: fazy nadtlenku wodoru, fazy ozonowej, po której następuje tworzenie peroksonu i jednogodzinnej fazy kontaktu, podczas której perokson ulegał rozkładowi. Ze względów bezpieczeństwa urządzenie wykrywa resztkowy poziom nadtlenku wodoru po procedurze odkażania.
4.3. Badania mikrobiologiczne
Użyliśmy próbnika powietrza MicroBio MB 1 PLUS (Parrett, Bromley, Wielka Brytania) do pomiaru obciążenia mikrobiologicznego w powietrzu. Próbnik powietrza MicroBio MB1 zbiera unoszące się w powietrzu mikroorganizmy na powierzchni szalek Petriego ułożone warstwowo z ekstraktem słodowym agarem i tryptycznym agarem sojowym. Po ekspozycji naczynia zostały usunięte i inkubowane w warunkach tlenowych, a wzrosty kolonii zostały policzone. Do obliczenia liczby jtk na m3 wykorzystano liczbę próbek powietrza i objętość jtk. W naszym badaniu obliczyliśmy średnie wartości jtk/m3 z trzech próbek powietrza. Urządzenie umieszczono 1,5 m od podłogi, zamknięto wszystkie drzwi i okna, a 300 m3 powietrza pobrano trzykrotnie zgodnie z normą PN—EN 13098 zatwierdzoną przez Polski Komitet Normalizacyjny [45].
Użyliśmy 25 cm2, wypukłych płyt RODAC (Replicate Organism Detection and Counting) warstwowych tryptycznym agarem sojowym z inaktywatorami substancji hamujących do pomiaru zanieczyszczenia powierzchni (stół do rozcinania, powierzchnia robocza stołu sekcyjnego, podłoga, powierzchnia robocza wózka narzędziowego, powierzchnia siedząca krzesła). Płyty były dociskane (500 g/cm2) do powierzchni przez 10 sekund, bez ruchów bocznych, a następnie inkubowano w temperaturze 35 °C w warunkach tlenowych. Wzrost mikroorganizmów mierzono w jtk na 100 cm2, a następnie wyrażano jako poziom ryzyka zgodnie z projektem normy europejskiej CEN/TC 243/WG2 z 1993 r.[ 46]; było to: niskie ryzyko, <10 jtk/100 cm2; umiarkowane ryzyko, 10–100; wysokie ryzyko, >100–1000, bardzo wysokie ryzyko, >1000.
Identyfikacja bakterii została przeprowadzona za pomocą automatycznego systemu wykrywania Vitek2®(Biomerieux, Marcy-l’Étoile, Francja), zgodnie z instrukcjami producenta. VITEK2®to zautomatyzowany system identyfikacji mikrobiologicznej spektrometrii mas, który wykorzystuje technologię Matrix-Assisted Laser Desorption Ionization Time-of-Flight (MALDI-TOF). Gatunki grzybów zidentyfikowano poprzez ocenę ich makroskopowych i mikroskopijnych cech morfologicznych na podstawie Atlasu Grzybów Klinicznych [47].
Wkład autora
Konceptualizacja, P.T.; Metodologia, P.T.; Analiza formalna, P.T., A.B.-S., A.N.-O., K.K., B.G., R.K.; Dochodzenie, A.B.-S., M.B.; Data Curation, P.T.; Pisanie – przygotowanie oryginalnego szkicu, P.T., A.N.-O., K.K.; Pisanie — recenzja i edycja, R.K.; Nadzór, P.T.; Administracja projektów, P.T. Wszyscy autorzy przeczytali i zgodzili się na opublikowaną wersję manuskryptu.
Finansowania
Badania te nie otrzymały finansowania zewnętrznego.
Konflikty interesów
Autorzy deklarują brak konfliktu interesów.
References
Nolte, K.B.; Taylor, D.G.; Richmond, J.Y. Biosafety considerations for autopsy. Am. J. Forensic Med. Pathol. 2002, 23, 107–122. [Google Scholar] [CrossRef] [PubMed]
Stephenson, L.; Byard, R.W. Issues in the handling of cases of tuberculosis in the mortuary. J. Forensic Leg. Med. 2019, 64, 42–44. [Google Scholar] [CrossRef] [PubMed]
Li, L.; Gu, J.; Shi, X.; Gong, E.; Li, X.; Shao, H.; Shi, X.; Jiang, H.; Gao, X.; Cheng, D.; et al. Biosafety Level 3 Laboratory for Autopsies of Patients with Severe Acute Respiratory Syndrome: Principles, Practices, and Prospects. Clin. Infect. Dis. 2005, 41, 815–821. [Google Scholar] [CrossRef] [PubMed]
Brooks, E.G.; Utley-Bobak, S.R. Autopsy Biosafety. Acad. Forensic Pathol. 2018, 8, 328–339. [Google Scholar] [CrossRef] [PubMed]
Schwarz, P.; Dannaoui, E.; Gehl, A.; Felske-Zech, H.; Birngruber, C.G.; Dettmeyer, R.B.; Verhoff, M.A. Molecular identification of fungi found on decomposed human bodies in forensic autopsy cases. Int. J. Leg. Med. 2015, 129, 785–791. [Google Scholar] [CrossRef]
Łukaszuk, C.; Krajewska-Kułak, E.; Guzowski, A.; Kraszyńska, B.; Grassmann, M.; Dobrowolski, R. Analysis of the incidence fungi in a crypt cemetery. J. Air Waste Manag. Assoc. 2015, 65, 1141–1147. [Google Scholar] [CrossRef]
Tarka, P.; Nitsch-Osuch, A.; Gorynski, P.; Tyszko, P.; Bogdan, M.; Kanecki, K. Epidemiology of Pulmonary Aspergillosis in Hospitalized Patients in Poland During 2009–2016. In Advances in Pulmonary Medicine: Research and Innovations; Pokorski, M., Ed.; Springer: Cham, Switzerland, 2019; Volume 1160, pp. 73–80. [Google Scholar] [CrossRef]
Fu, X.; Guo, J.; Finkelbergs, D.; He, J.; Zha, L.; Guo, Y.; Cai, J. Fungal succession during mammalian cadaver decomposition and potential forensic implications. Sci. Rep. 2019, 9. [Google Scholar] [CrossRef]
Ishii, K.; Hitosugi, M.; Kido, M.; Yaguchi, T.; Nishimura, K.; Hosoya, T.; Tokudome, S. Analysis of fungi detected in human cadavers. Leg. Med. 2006, 8, 188–190. [Google Scholar] [CrossRef]
Sri-indrasutdhi, V.; Ueapattanakit, J.; Sommatas, A. Investigation of airborne fungi and their ability to grow on formalin-fixed human cadavers. Mycosphere 2015, 6, 729–736. [Google Scholar] [CrossRef]
Chimutsa, M.; Olakanye, A.O.; Thompson, T.J.U.; Ralebitso-Senior, T.K. Soil fungal community shift evaluation as a potential cadaver decomposition indicator. Forensic Sci. Int. 2015, 257, 155–159. [Google Scholar] [CrossRef]
Burton, J.L. Health and safety at necropsy. J. Clin. Pathol. 2003, 56, 254–260. [Google Scholar] [CrossRef]
Xu, X.; Goddard, W.A. Peroxone chemistry: Formation of H2O3 and ring-(HO2)(HO3) from O3/H2O2. Proc. Natl. Acad. Sci. USA 2002, 99, 15308–15312. [Google Scholar] [CrossRef]
United States Environmental Protection Agency. Alternative Disinfectants and Oxidants Guidance Manual. 1999. Available online: https://nepis.epa.gov/Exe/ZyPDF.cgi/2000229L.PDF?Dockey=2000229L.PDF (accessed on 22 May 2020).
Litter, M. Introduction to Photochemical Advanced Oxidation Processes for Water Treatment. In Environmental Photochemistry Part II; Boule, P., Bahnemann, D., Robertson, P., Eds.; Springer: Berlin/Heidelberg, Germany, 2005; ISBN 978-3-540-00269-7. [Google Scholar]
Garvey, M.I.; Bradley, C.W.; Jumaa, P. Environmental decontamination following occupancy of a burns patient with multiple carbapenemase-producing organisms. J. Hosp. Infect. 2016, 93, 136–140. [Google Scholar] [CrossRef] [PubMed]
Blazejewski, C.; Wallet, F.; Rouzé, A.; Le Guern, R.; Ponthieux, S.; Salleron, J.; Nseir, S. Efficiency of hydrogen peroxide in improving disinfection of ICU rooms. Crit. Care 2015, 19, 30. [Google Scholar] [CrossRef] [PubMed]
Donskey, C.J. Decontamination devices in health care facilities: Practical issues and emerging applications. Am. J. Infect. Control 2019, 47, A23–A28. [Google Scholar] [CrossRef] [PubMed]
Steindl, G.; Fiedler, A.; Huhulescu, S.; Wewalka, G.; Allerberger, F. Effect of airborne hydrogen peroxide on spores of Clostridium difficile. Wien. Klin. Wochenschr. 2015, 127, 421–426. [Google Scholar] [CrossRef]
Fu, T.Y.; Gent, P.; Kumar, V. Efficacy, efficiency and safety aspects of hydrogen peroxide vapour and aerosolized hydrogen peroxide room disinfection systems. J. Hosp. Infect. 2012, 80, 199–205. [Google Scholar] [CrossRef]
Lowe, J.J.; Gibbs, S.G.; Iwen, P.C.; Smith, P.W.; Hewlett, A.L. Decontamination of a Hospital Room Using Gaseous Chlorine Dioxide: Bacillus anthracis, Francisella tularensis, and Yersinia pestis. J. Occup. Env. Hyg. 2013, 10, 533–539. [Google Scholar] [CrossRef]
Moat, J.; Cargill, J.; Shone, J.; Upton, M. Application of a novel decontamination process using gaseous ozone. Can. J. Microbiol. 2009, 55, 928–933. [Google Scholar] [CrossRef]
Munter, R. Advanced oxidation processes-current status and prospects. Proc. Est. Acad. Sci. Chem. 2001, 50, 59–80. [Google Scholar]
Koburger, T.; Below, H.; Dornquast, T.; Kramer, A. Decontamination of room air and adjoining wall surfaces by nebulizing hydrogen peroxide. GMS Krankenhhyg. Interdiszip. 2011, 6, Doc09. [Google Scholar] [CrossRef] [PubMed]
European Parliament. Directive 2000/54/EC of the European Parliament and of the Council of 18 September 2000 on the protection of workers from risks related to exposure to biological agents at work. Off. J. Eur. Commun. 2000, L262, 21–45. [Google Scholar]
Hardin, N.J. Infection control at autopsy: A guide for pathologists and autopsy personnel. Curr. Diagn. Pathol. 2000, 6, 75–83. [Google Scholar] [CrossRef]
Polish Committee for Standardization. Chemical Disinfectants and Antiseptics. Methods of Airborne Room Disinfection by Automated Process. Determination of Bactericidal, Mycobactericidal, Sporicidal, Fungicidal, Yeasticidal, Virucidal and Phagocidal Activities; EN 17272:2020. 2020. Available online: https://shop.bsigroup.com/ProductDetail?pid=000000000030374486 (accessed on 22 May 2020).
Totaro, M.; Costa, A.; Casini, B.; Profeti, S.; Gallo, A.; Frendo, L.; Porretta, A.; Valentini, P.; Privitera, G.; Baggiani, A. Microbiological Air Quality in Heating, Ventilation and Air Conditioning Systems of Surgical and Intensive Care Areas: The Application of a Disinfection Procedure for Dehumidification Devices. Pathogens 2019, 8, 8. [Google Scholar] [CrossRef] [PubMed]
Fukutomi, Y.; Taniguchi, M. Sensitization to fungal allergens: Resolved and unresolved issues. Allergol. Int. 2015, 64, 321–331. [Google Scholar] [CrossRef]
Kwon-Chung, K.J.; Sugui, J.A. Aspergillus fumigatus—What Makes the Species a Ubiquitous Human Fungal Pathogen? PLoS Pathog. 2013, 9, e1003743. [Google Scholar] [CrossRef]
Hedayati, M.T.; Pasqualotto, A.C.; Warn, P.A.; Bowyer, P.; Denning, D.W. Aspergillus flavus: Human pathogen, allergen and mycotoxin producer. Microbiology 2007, 153, 1677–1692. [Google Scholar] [CrossRef]
Baranyi, N.; Kocsubé, S.; Jakšić Despot, D.; Šegvić Klarić, M.; Szekeres, A.; Bencsik, O.; Kecskeméti, A.; Manikandan, P.; Tóth, B.; Kredics, L.; et al. Combined genotyping strategy reveals structural differences between Aspergillus flavus lineages from different habitats impacting human health. J. Basic Microbiol. 2017, 57, 899–909. [Google Scholar] [CrossRef]
Desai, M.R.; Ghosh, S. Occupational exposure to airborne fungi among rice mill workers with special reference to aflatoxin producing A. flavus strains. Ann. Agric. Environ. Med. 2003, 10, 159–162. [Google Scholar]
Kowalska, A.; Walkiewicz, K.; Kozieł, P.; Muc-Wierzgoń, M. Aflatoxins: Characteristics and impact on human health. Postepy Hig. Med. Dosw. 2017, 71, 315–327. [Google Scholar] [CrossRef]
Kespohl, S.; Raulf, M. Mold Sensitization in Asthmatic and Non-asthmatic Subjects Diagnosed with Extract-Based Versus Component-Based Allergens. In Medical Science and Research; Pokorski, M., Ed.; Springer: Cham, Switzerland, 2019; Volume 1153. [Google Scholar]
Zhang, Z.; Reponen, T.; Hershey, G.K. Fungal Exposure and Asthma: IgE and Non-IgE-Mediated Mechanisms. Curr. Allergy Asthma Rep. 2016, 16, 86. [Google Scholar] [CrossRef] [PubMed]
Batra, N.; Kaur, H.; Mohindra, S.; Singh, S.; Shamanth, A.S.; Rudramurthy, S.M. Cladosporium Sphaerospermum Causing Brain Abscess, a Saprophyte Turning Pathogen: Case and Review of Published Reports. J. Mycol. Med. 2019, 29, 180–184. [Google Scholar] [CrossRef] [PubMed]
Perrone, G.; Susca, A. Penicillium Species and Their Associated Mycotoxins. In Mycotoxigenic Fungi. Methods in Molecular Biology; Moretti, A., Susca, A., Eds.; Humana Press: New York, NY, USA, 2017; Volume 1542, pp. 107–119. [Google Scholar]
Ahmad, M.; Jacobs, D.; Wu, H.H.; Wolk, D.M.; Kazmi, S.A.J.; Jaramillo, C.; Toms, S.A. Cladophialophora Bantiana: A Rare Intracerebral Fungal Abscess—Case Series and Review of Literature. Surg. J. N. Y. 2017, 3, e62–e68. [Google Scholar] [CrossRef] [PubMed]
Cao, C.; Xi, L.; Chaturvedi, V. Talaromycosis (Penicilliosis) Due to Talaromyces (Penicillium) marneffei: Insights into the Clinical Trends of a Major Fungal Disease 60 Years After the Discovery of the Pathogen. Mycopathologia 2019, 184, 709–720. [Google Scholar] [CrossRef] [PubMed]
van de Voorde, H.; Van Dijck, P.J. Determination of the time of death by fungal growth. Z. Für Rechtsmed. 1982, 89, 75–80. [Google Scholar] [CrossRef] [PubMed]
Čavka, M.; Glasnović, A.; Janković, I.; Šikanjić, P.R.; Perić, B.; Brkljačić, B.; Mlinarić-Missoni, E.; Škrlin, J. Microbiological analysis of a mummy from the archeological museum in Zagreb. Coll. Antropol. 2010, 34, 803–805. [Google Scholar]
Hitosugi, M.; Ishii, K.; Yaguchi, T.; Chigusa, Y.; Kurosu, A.; Kido, M.; Nagai, T.; Tokudome, S. Fungi can be a useful forensic tool. Leg. Med. 2006, 8, 240–242. [Google Scholar] [CrossRef]
Sidrim, J.J.C.; Moreira Filho, R.E.; Cordeiro, R.A.; Rocha, M.F.G.; Caetano, E.P.; Monteiro, A.J.; Brilhante, R.S.N. Fungal microbiota dynamics as a postmortem investigation tool: Focus on Aspergillus, Penicillium and Candida species. J. Appl. Microbiol. 2010, 108, 1751–1756. [Google Scholar] [CrossRef]
Polish Committee for Standardization. Workplace Atmosphere—Guidelines for Measurement of Airborne Microorganisms and Endotoxins; PN-EN 13098:2007. Available online: http://normy.ekoinfonet.pl/ics.php?ic=07&kat=Powietrze%20na%20stanowiskach%20pracy (accessed on 22 May 2020).
European Committee for Standardization. CEN/TC 243—Cleanroom Technology. 1993. Available online: https://standards.iteh.ai/catalog/tc/cen/9f58539c-5394-4f44-afe3-8528a2e35e33/cen-tc-243 (accessed on 22 May 2020).
de Hoog, G.; Guarro, J.; Gené, J.; Figueras, M. Atlas of Clinical Fungi, 3rd ed.; CBS-KNAW Fungal Biodiversity Centre: Utrecht, The Netherlands, 2009. [Google Scholar]
© 2020 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/)



















